Definición
La tabla periódica es el ordenamiento de los elementos químicos de manera creciente en función del número atómico presente en cada uno, generando una relación entre las propiedades químicas y física de los elementos químicos.
Hoy día sabemos que la química es una ciencia ancestral, y por lo tanto el descubriendo de los elementos químicos así como de sus propiedades ha aumentado al pasar de los años; ya para el siglo XIX existía una gran cantidad de elementos químicos y surgió la necesidad de ordenar y agrupar todos los elementos, de manera tal que el químico pudiera trabajar más ordenadamente y lograra encontrar de una manera más fácil y rápida estos elementos con sus propiedades, tales como: masa atómica, punto de fusión, densidad, entre otros.
Evolución de la tabla periódica, sobre los modelos de Newlands, Meyer, Mendeleev y Mosey
Una de los primeros indicios sobre el ordenamiento de los elementos, fue propuesto por el químico inglés John Newlands en 1864, el cual propuso ordenar los elementos de acuerdo a su masa atómica, es decir, a la suma del número de protones y neutrones que contiene cada elemento en su núcleo atómico, observando que al ordenar los elementos según su masa atómica, cada octavo elemento mostraba propiedades similares; sin embargo esta teoría no fue aceptada por la mayoría de la comunidad científica, ya que esta relación de cada octavo no se cumplía para elementos con masa atómica mayor que el calcio.
Años más tarde el químico ruso Mendeleev y el químico alemán Meyer proponen independientemente un ordenamiento mucho más amplio en función a la periodicidad de los elementos, ellos encontraron que al ordenar cada uno de estos elementos en orden creciente de sus masas atómicas sus propiedades químicas aparecían periódicamente. El trabajo descrito por Mendeleev atrajo mayor atención, pues él dejo en su ordenamiento espacios en blanco que correspondían a elementos químicos que para ese entonces no se conocían, pero que debían tener las características de los elementos más cercanos.
Mendeleev organizó los elementos en la tabla periódica en ocho grupos y doce filas, sin embargo, debió romper el orden de la masa atómica creciente ya mencionado, para poder situar algunos elementos en los grupos adecuados, asumiendo que algunos de estos debían tener errores en su masa atómica, a medida que pasaron los años se fueron incorporando nuevos elementos químicos a la tabla propuesta por Mendeleev se fueron presentando algunas incongruencias, por lo que se llevó a pensar entre los científicos de la época que debía existir una propiedad diferente a la masa atómica en la cual se basará la periodicidad de los elementos.
No fue hasta 1913 que el físico inglés, Henry Mosey encontró una relación entre lo que él llamó número atómico (cantidad total de protones en cada átomo) y la frecuencia de rayos X que se generaba al bombardear un elemento químico con electrones de alta energía, lo que hizo posible determinar el número atómico de cada elemento; Monsey encontró que al organizar los elementos en orden creciente de sus números atómicos las propiedades se repiten periódicamente. Partiendo de estos estudios hoy día se tiene una tabla periódica larga con más de 118 elementos y se conoce como tabla periódica moderna.
Esta tabla periódica moderna contiene la información de cada elemento químico en un recuadro de la siguiente manera:
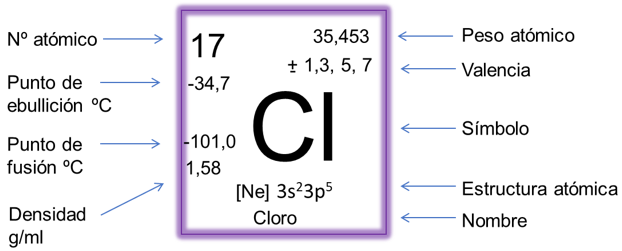
La mayoría de las tablas periódicas hoy día contienen la mayor información de cada elemento con respecto a sus propiedades físicas y químicas tales como número atómico, punto de fusión, punto de ebullición, densidad, valencia, peso atómico y estructura química o configuración electrónica, sin embargo, existen otras que contienen información más completa, añadiendo valores sobre, radio atómico, energía de ionización, afinidad electrónica, conductividad, entre otros.
¿Cómo se clasifican los elementos en la tabla periódica?
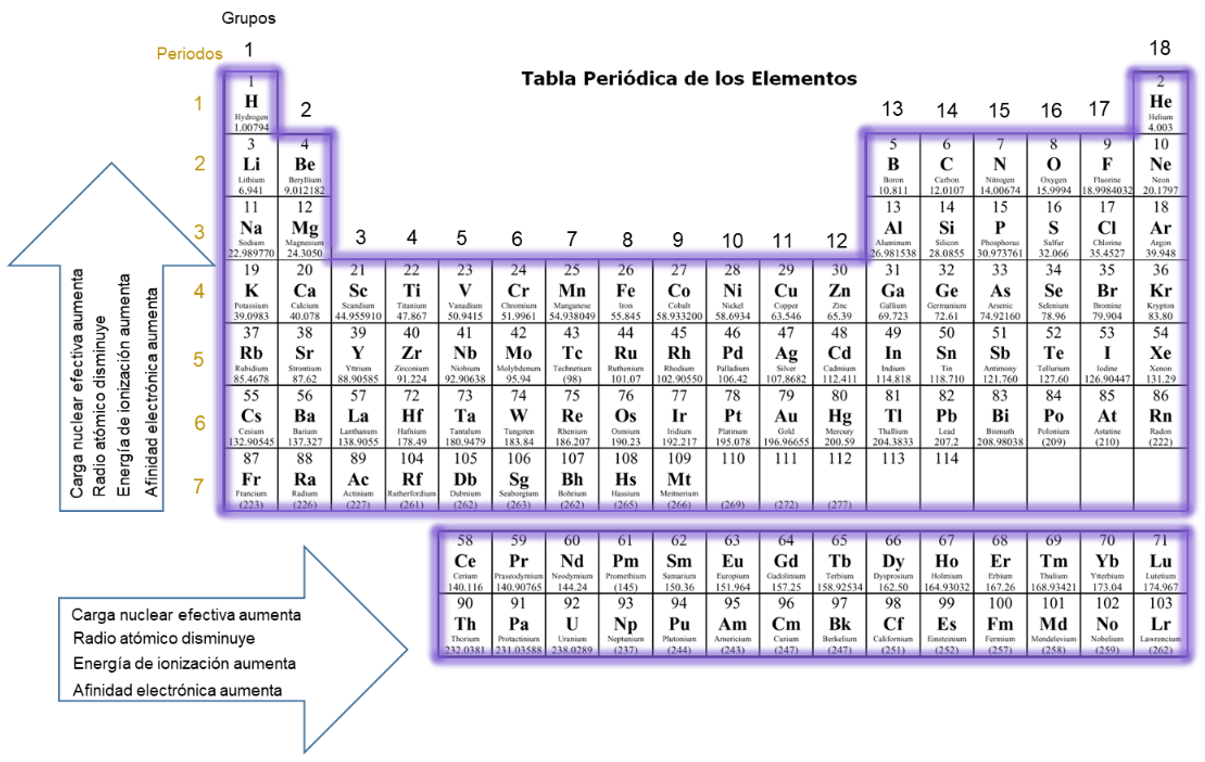
Los elementos en la tabla periódica moderna (figura 1) se encuentran ordenados de acuerdo a su número atómico de forma creciente, en siete filas horizontales llamadas periodos y en dieciocho columnas verticales conocidas como grupos o familias, en función a las semejanzas de las propiedades químicas.
Los periodos se enumeran en el extremo izquierdo de la tabla periódica, por ejemplo, el primer periodo de la tabla periódica está formado sólo por dos elementos hidrógeno y helio, luego le siguen dos periodos de ocho elementos cada uno, el segundo periodo contiene al litio, berilio, boro, carbono, nitrógeno, oxígeno, flúor y neón; y el tercer periodo que está conformado por sodio, magnesio, aluminio, silicio, fósforo, azufre, cloro y argón.
El cuarto y quinto periodo están formados por dieciocho elementos el sexto contiene treinta y dos elementos los cuales una parte son extraídos y organizados en la parte inferior de la tabla llamados lantánidos y de igual forma ocurre con el séptimo periodo donde se denomina al grupo extraído como actínidos.
Por otro lado, los grupos según la unión internacional de química aplicada (IUPAC) son nombrados bajo una numeración sencilla que va desde el número uno hasta el dieciocho. Sin embargo, algunos grupos tienen nombres especiales tales como metales alcalinos para los elementos del grupo uno (Li, Na, K, Rb, Cs y Fr), metales alcalinotérreos para los elementos del grupo dos (Be, Mg, Ca, Sr, Ba y Ra), halógenos para los elementos del grupo siete (F, Cl, Br, I y At) y gases nobles para los elementos del grupo ocho (He, Ne, Ar, Kr, Xe y Rn).
Los elementos a su vez se dividen en tres categorías: los metales, los cuales son aquellos elementos que tienen la propiedad de ser un buen conductor de calor y electricidad, los no metales que por lo general no son buenos conductores de electricidad, y los metaloides los cuales tienen un comportamiento intermedio entre las categorías ya mencionadas.
¿Cómo es el comportamiento químico de los elementos en la tabla periódica?
Es indiscutible que los elementos presentan variaciones periódicas en sus propiedades físicas y por ende en su comportamiento químico (figura 1), por ejemplo el tamaño del átomo el cual es definida en términos de su radio atómico se determina por la fuerza de atracción entre los electrones de niveles externo y el núcleo, es decir la carga nuclear efectiva de cada elemento; a medida que la carga nuclear efectiva aumenta, los electrones son atraídos con más fuerza por el núcleo y por ende el radio atómico disminuye, es por esta razón que el radio atómico aumenta cuando vamos de arriba hacia abajo en un grupo y de derecha a izquierda a lo largo de un periodo, mientras que la carga nuclear efectiva aumenta de izquierda a derecha en un periodo y de abajo hacia arriba en un grupo.
Otro comportamiento importante que mencionar en función de a la periodicidad de los elementos, es la de la energía de ionización (entendiendo la energía mínima precisa para quitar un electrón de un átomo que se encuentra en estado gaseoso, en su estado fundamental), cuanto mayor es la energía de ionización es más difícil quitar el electrón, en la tabla periódica esta energía aumenta de izquierda a derecha en un periodo y de abajo hacia arriba en un grupo; otra propiedad de los átomos que influye en su comportamiento químico es la denominada afinidad electrónica la cual está asociada a la capacidad que posee cada elemento de aceptar uno o más electrones, esta aumenta cuando vamos de abajo hacia arriba en un grupo y de izquierda a derecha a lo largo de un periodo.
Referencias bibliográficas
1. Brown T.L; LeMay H.E; Bursten B.E; Burdge J.R. Química General, 12va Edición. Editorial Pearson, (2014).2. Petrucci, R.H; Herring, F. G; Madura, J.D; Bissonnette, C. Química General, 8a Edición. Editorial Pearson, (2003).
Autora
 Escrito por Mahiceth Quintero Valero para la Edición #105 de Enciclopedia Asigna, en 10/2021. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #105 de Enciclopedia Asigna, en 10/2021. Mahiceth es Doctora en Química Aplicada