El hidrógeno es el elemento químico más sencillo que se encuentra en la tabla periódica dentro del grupo 1A, es representado por la letra H y forma parte de los elementos representativos no metálicos, su forma atómica más frecuente es aquella que esta constituida por un protón y un electrón.
Propiedades
El hidrógeno no forma parte de la atmosfera terrestre debido a que el liviano peso de estas moléculas no puede ser retenida en la atmosfera, por lo que este compuesto se encuentra en poca cantidad en la superficie de la tierra en un aproximado de 0,5ppm; sin embargo, este elemento forma parte de la mayoría de los compuestos que se encuentran en la tierra.
El hidrógeno en su estado elemental es una molécula diatómica H2 ya que para que se encuentre en un estado atómico debe estar a temperaturas muy elevadas. El hidrógeno molecular es un gas incoloro e inodoro no es toxico, pero es altamente inflamable y posee un punto de ebullición de -252,9ºC. La configuración electrónica del hidrógeno en su estado fundamental H es 1s2, este tiene la propiedad de poder oxidarse y formar el ion H+, pero también la facilidad de transformarse en un anión llamado anión hidruro H–; el hidrógeno es el único elemento que tiene la propiedad de formar enlaces por medio de puentes de hidrógeno.
La molécula diatómica de hidrógeno H2, posee dos electrones ambos en el orbital σ1s, también tiene un orden de enlace de 1 y su diagrama de orbital molecular corresponde a la siguiente imagen (figura 1):
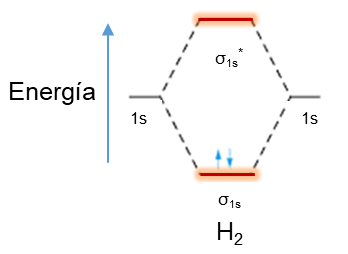
Figura 1. Diagrama de orbitales moleculares para el H2
Mientras que el H2+ posee un único electrón y se encuentra ubicado en el orbital σ1s el cual representa un orbital molecular enlazante y contiene un orden de enlace de ½ lo que equivale a un electrón o medio enlace y su diagrama de orbital molecular corresponde a la siguiente imagen (figura 2).
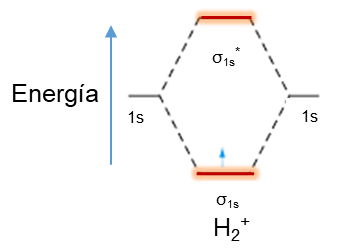
Figura 2. Diagrama de orbital moleculares para el H2+
Por otro lado, el hidrógeno es el único elemento que tiene tres tipos de isotopos que reciben diferentes nombres y estos son: 1H (hidrógeno o protio), 2H (deuterio) que se reconoce con el símbolo D y 3H (tritio) representado por el símbolo T. En la naturaleza solo se encuentran estables los isotopos de 1H (hidrógeno o protio) y 2H (deuterio) los cuales corresponden al 99,98% y 0,015% respectivamente, mientras que el tritio es un isotopo radiactivo.
Obtención
Observándose como una molécula diatómica puede obtenerse como el producto de una reacción netamente exotérmica entre los átomos de hidrógeno, como se muestra a continuación:
H(g) + H(g) → H2(g)
Sin embargo, se puede obtener a partir de algunos otros compuestos como por ejemplo del agua, donde se disminuye el estado de oxidación H desde el +1 en la molécula de agua (H2O) hasta el 0 en el hidrógeno molecular H2, por lo tanto, para que ocurra esto debe existir un agente reductor como el carbón, el monóxido de carbono o un hidrocarburo como el metano o propano. A continuación, se muestran las reacciones para obtener H2 partiendo de vapor de agua la cual se conoce como reacciones de gas de agua.
C(s) + H2O(g) → CO(g) + H2(g)
CO(g) + H2O(g) → CO2(g) + H2(g)
Como ya se indicó el hidrógeno puede prepararse también partiendo de un hidrocarburo (metano o propano), el cual es un proceso muy utilizado a nivel industrial y en la refinería de petróleo, a continuación, se muestran las reacciones:
CH4(g) + H2O(g) → CO(g) + 3H2(g)
C3H8(g) + 3H2O(g) → 3CO(g) + 7H2(g)
A nivel de laboratorio el hidrógeno se puede obtener a partir de la reacción de metales activos como el zinc con ácido clorhídrico, tal como se muestra a continuación:
Zn(s) + 2HCl(ac) → ZnCl2(ac) + H2(g)
En el laboratorio frecuentemente se utilizan otros métodos de obtención como por ejemplo la electrólisis del agua y las reacciones entre los metales alcalinos o alcalinotérreo y el agua (Ca o Ba).
Compuestos del hidrógeno
El hidrógeno forma compuestos binarios con otros elementos metales o no metálicos llamados hidruros, y se clasifican en tres grupos, covalentes, iónicos y metálicos. Los hidruros covalentes son aquellos en el que el átomo de hidrógeno forma un enlace covalente y no un metal, por ejemplo, el HCl y el NH3, reacción que se muestra a continuación.
H2(g) + Cl2(g) → 2HCl(g)
3H2(g) + N2(g) → 2NH3(g)
Los Hidruros iónicos están formados por el hidrógeno y los metales alcalinos y alcalinotérreos que corresponden al grupo 1 y 2. Se caracterizan por poseer el ion hidruro H-. Un ejemplo de estas reacciones se muestra a continuación.
2Li(s) + H2(g) → 2LiH(s)
Ca(s) + H2(g) → CaH2(s)
Finalmente, los hidruros metálicos se obtienen al reaccional el hidrógeno con los elementos de transición, estos elementos por lo general no son estequiométricos, por lo tanto, la relación entre el átomo de H y los átomos del metal varían. Por ejemplo, la formula del hidruro de titanio puede variar entre TiH1,8 y TiH2 dependiendo de las condiciones en las que se encuentre.
Ejemplos de aplicación del hidrógeno
Como la mayoría del hidrógeno se produce in situ a nivel industrial, es utilizado en la refinería en donde es producto de algunos procesos y se consume en otros, como por ejemplo en los procesos de hidrogenación y hidrotratamientos que ayudan a la obtención de gasolina con un alto octanaje. El hidrógeno también es utilizado en la síntesis de amoniaco NH3, ácido clorhídrico HCl y metano CH3OH.
Autora
 Escrito por Mahiceth Quintero Valero para la Edición #111 de Enciclopedia Asigna, en 05/2022. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #111 de Enciclopedia Asigna, en 05/2022. Mahiceth es Doctora en Química Aplicada