Los aminoácidos son compuestos orgánicos que están constituidos, tal como su nombre lo indica, por un grupo amino (-NH2) que tiene un carácter básico y un grupo carboxílico (-COOH) que posee un carácter ácido. La unión sucesiva de estos aminoácidos entre sí da como resultado polímeros lineales, los cuales forman macromoléculas como las proteínas.
En este espectro, las proteínas, desde el punto de vista químico, son moléculas orgánicas complejas las cuales se derivan de los ácidos α-aminocarboxilico, una molécula proteica contiene cientos y hasta miles de unidades de aminoácidos. Las proteínas se encuentran en toda la célula viva y forman parte del cuerpo animal permitiendo su funcionamiento. Debido al papel fundamental que juegan en los organismos vivos, se puede decir que los aminoácidos son igual de importantes, ya que estos constituyen las unidades fundamentales de estas macromoléculas.
¿Cuál es la estructura de los aminoácidos?
Como se mencionó anteriormente, los aminoácidos están conformados por un grupo amino y un grupo carboxílico, estos se encuentran enlazados con el mismo átomo de carbono asimétrico, es decir se encuentran unidos a través de un carbono α.
Un ejemplo simple que nos ayudará a comprender la estructura de los aminoácidos es tomar como referencia la glicina, el cual es el aminoácido más sencillo y se considera como el compuesto base (figura 1).
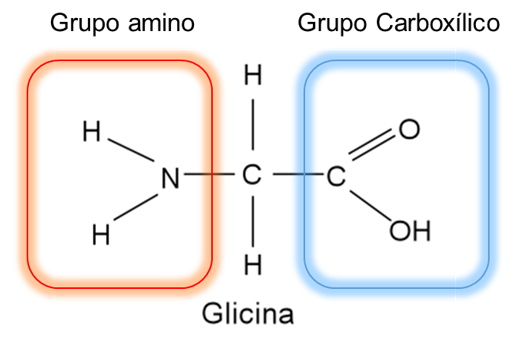
Figura 1. Molécula de glicina
La unión química de algunos compuestos base, como la glicina y la alamina (figura 2), se da mediante una reacción de condensación donde se une el carbono del grupo carboxilo de una molécula con el nitrógeno del grupo amino de la otra molécula, formando así un enlace covalente carbono-nitrógeno denominado enlace peptídico. Esta molécula formada se denomina dipéptido, ya que está constituida por dos aminoácidos, los cuales están unidos a su vez por un enlace peptídico; de la misma forma, cuando una molécula tiene tres aminoácidos unidos por este tipo de enlace se denomina tripéptido, cuando tiene cuatro se llaman tetrapéptido y así sucesivamente a medida que aumenta la cantidad de aminoácidos unidos.
Cuando una molécula está constituida por más de 30 aminoácidos entonces son consideradas como polipéptidos, un ejemplo de estos polipéptidos son las proteínas, las cuales están constituidas de una o más cadenas polipeptidicas. Estos polipéptidos contienen un grupo amino en un extremo y en el otro un grupo carboxilo libre, que pertenece simplemente al último aminoácido adicionado a la cadena, el resto de los grupos amino y carboxilo son parte de los enlaces peptídicos.
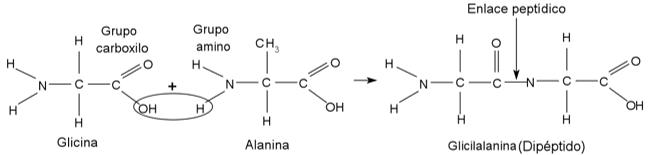
Figura 2. Reacción de glicina y alanina. Formación de enlaces peptídicos
¿Cómo se clasifican los aminoácidos?
Los aminoácidos pueden clasificarse dependiendo de la ubicación del grupo amino en la cadena carbonada principal que contiene al ácido. Por ejemplo: podemos decir que se trata de un aminoácido α si el grupo amino está enlazado al carbono α (segundo carbono) de la cadena, un aminoácido β si el grupo amino está enlazado al carbono β (tercer carbono) (figura 3) y así sucesivamente.
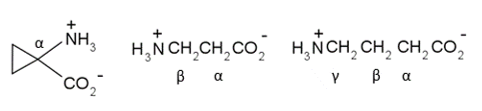
Figura 3. Aminoácidos α, β y γ
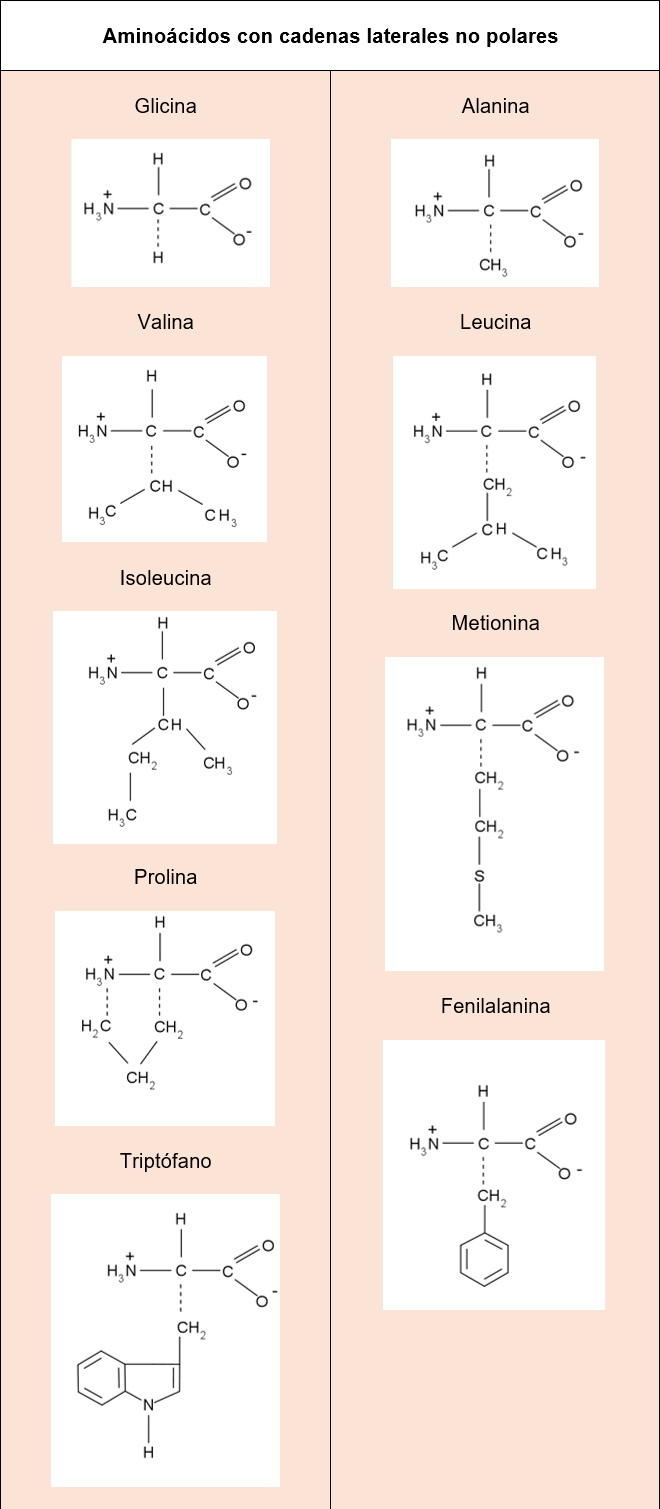
Hoy día encontramos en la naturaleza una gran variedad de aminoácidos, sin embargo, entre esta numerosa variedad se puede resaltar un grupo de 20 aminoácidos (tabla 1) denominados estándar o comunes, los cuales son los aminoácidos codificados en la síntesis de proteínas conducidas por el ADN. Se puede observar en la tabla 1, que estos 20 aminoácidos son del tipo α-aminoácidos, y que se diferencian entre sí debido a las distintas cadenas ramificadas que contienen, ya que estas varían en tamaño y forma. Por lo tanto, la diferencia en las cadenas ramificadas hace que cada uno de estos aminoácidos tengan propiedades ácido-base distintas, así como su comportamiento electrónico (polar o no polar). En función a esto se pueden agrupar según las propiedades de sus cadenas laterales:
Cadenas laterales no polares (No hay diferencia de electronegatividad entre los átomos enlazados): Como se referenció anteriormente, la glicina es el aminoácido más pequeño y tal como se observa en la tabla 1, no contiene cadena lateral y por tanto su estructura es la que le ofrece a la cadena polipeptídica flexibilidad. Por otro lado, los siguientes cuatro aminoácidos presentados en la tabla 1, como la alanina, valina, leucina e isoleucina, poseen grupos alquilo (R) como cadena lateral (R=metilo, isopropilo, isobutilo, Sec-butilo) que les dan un carácter hidrofóbico, es decir estas moléculas no son capaces de interaccionar con la molécula del agua y por tanto no son solubles en agua. En este caso, su comportamiento electrónico es similar.
Podemos ver que el tamaño de la molécula puede variar haciéndose más compleja cada vez, lo que permite un cambio en la solubilidad de cada una de estas. En este sentido y a diferencia de los 4 aminoácidos anteriormente mencionados, la metionina en su estructura posee un átomo de azufre en la cadena lateral, lo que permite que esta sea un poco polarizable y le da a la molécula la capacidad de formar o participar en fuerzas intermoleculares débiles, mientras que la alanina, valina, leucina e isoleucina no poseen dicha capacidad.
Por otro lado, la prolina, fenilalanina y el triptófano son un poco más complejas pues contienen en sus cadenas laterales anillos o cadenas cerradas cíclicas lo que limita la flexibilidad de la molécula y tienden a ser aún más hidrofóbicas.
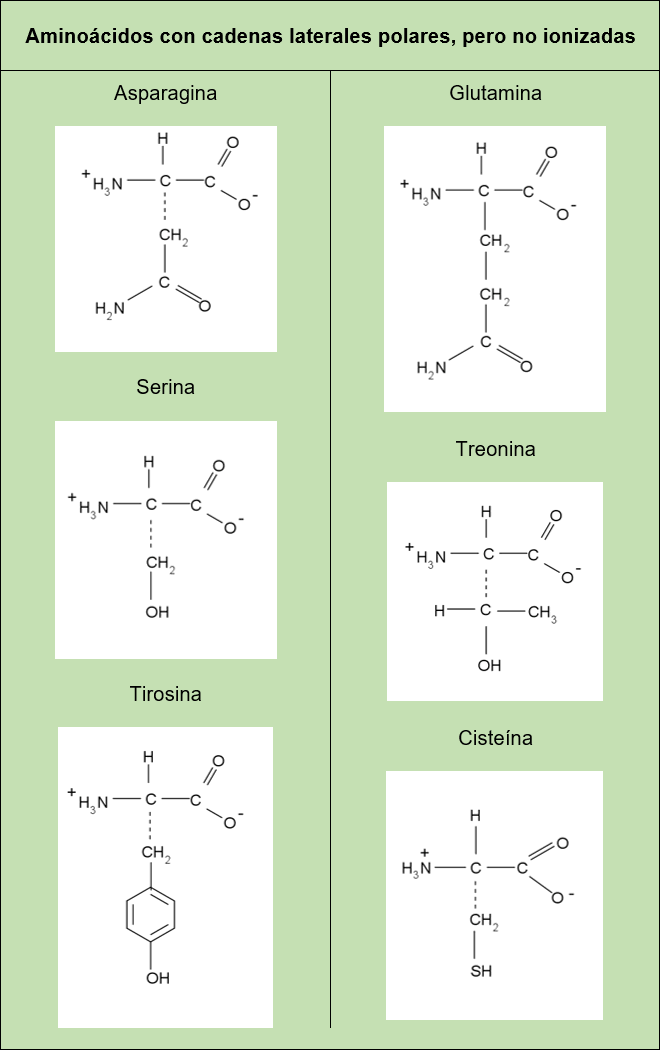
Aminoácidos con cadenas laterales polares (hay diferencia de electronegatividad entre los átomos enlazados), pero no ionizadas: Dentro de esta clasificación se encuentran los aminoácidos que contienen en su cadena lateral un grupo OH, tales como la serina, treonina y tirosina. Estas por ser cadenas polares pueden formar puentes de hidrógeno (fuerza atractiva entre un átomo pequeño como N, O, F ó Cl y un átomo de hidrógeno), sin embargo, la facilidad de esta formación se ve afectada en cada una de estas dependiendo de quién acompañe al grupo OH. Por ejemplo, entre la serina y treonina la diferencia en su cadena es que la treonina tiene un grupo metilo (CH3) en lugar de uno de los hidrógenos del carbono unido al grupo OH, el cual obstaculiza estéricamente al grupo OH haciendo menos efectiva la formación de puentes de hidrógeno, es decir, el volumen del grupo metilo impide o hace más difícil que estas interactúen con otra molécula. Otros de los aminoácidos que se encuentran dentro de esta clasificación son aquellos que contienen en su cadena lateral el grupo amida, como lo son la asparagina y la glutamina, este grupo es bastante polar y por lo tanto permite una fácil interacción con la molécula de agua.
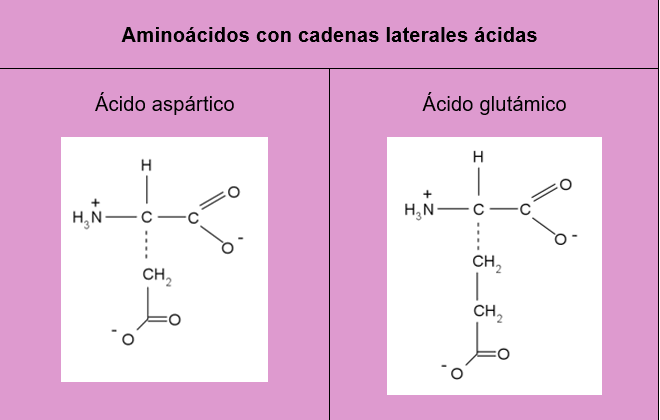
Aminoácidos con cadenas laterales ácidas: Como se muestra en la tabla 1, dentro de esta clasificación se encuentra el ácido aspártico y el ácido glutámico, en este caso el grupo CO2H de su cadena laterales se encuentra desprotonado, es decir pierden el átomo de hidrógeno hasta formar la especie CO2-, la cual es rica en electrones y permite formar fácilmente enlaces con especies de carga positiva.
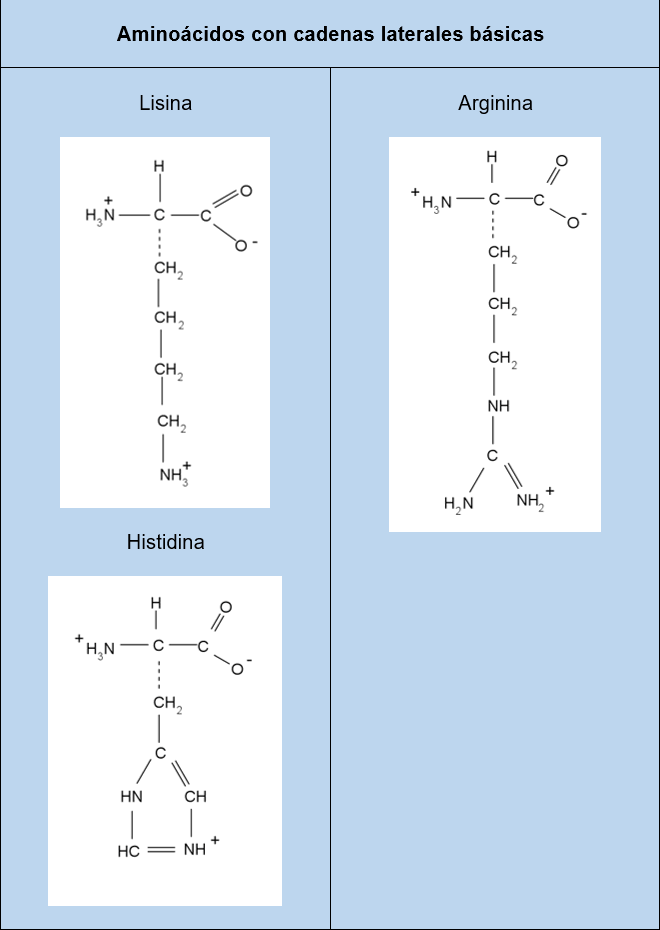
Aminoácidos con cadenas laterales básicas: Se dice que estos aminoácidos son básicos porque sus cadenas laterales poseen una carga positiva debido a la disociación del grupo amino en su cadena lateral, y por lo tanto forman enlaces con especies que contienen iones negativos. Entre ellos se encuentran la lisina, arginina e histidina, cada una de ellas poseen cadenas laterales con carácter básico distinto en función de la cantidad de grupos aminos y la complejidad de la molécula.
Tablas con los 20 aminoácidos más comunes
¿Cómo se obtienen los aminoácidos?
Existen varias reacciones para la síntesis de aminoácidos, a continuación, se describirán sólo dos de ellas. Uno de los primeros métodos de síntesis fue descrito por Perkin en 1858, el cual consistió en la aminación (proceso de introducir un grupo amino NH2 en un compuesto orgánico) de un ácido α-halogenocarboxílico mediante una reacción de sustitución (figura 4), este método de síntesis tiende a dar rendimientos muy bajos del producto.
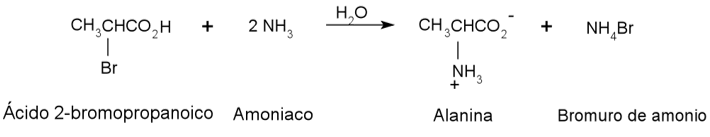
Figura 4. Reacción. Método de síntesis de Perkin
La síntesis de Strecker, es otra de las técnicas más utilizadas para obtener aminoácidos y consiste en transformar un aldehído en un aminoácido mediante dos etapas: en la primera etapa se forma un α-aminonitrilo el cual es un intermediario en la reacción, y se obtiene mediante la reacción de un aldehído con una sal de amonio y una fuente de iones de cianuro, en la segunda etapa ocurre una hidrólisis del grupo nitrilo de este intermediario para finalmente obtener el aminoácido, tal como se muestra en la siguiente reacción (figura 5).
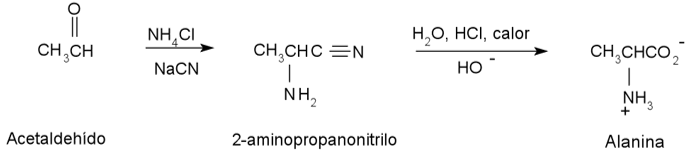
Figura 5. Reacción. Método de síntesis de Strecker
¿Qué tipos de niveles organizativos de las proteínas existen?
Tal como se mencionó anteriormente, las proteínas están conformadas por cadenas polipeptídicas, estas pueden torcerse o plegarse para formar una macromolécula con conformación tridimensional específica. Existen cuatro niveles de organización en las proteínas:
– A nivel primario, es comprendida la secuencia de aminoácidos que se encuentran unidos por los enlaces peptídicos.
– El nivel secundario refiere al resultado de la atracción por los puentes de hidrógeno formados en la molécula.
– A nivel terciario se observa la interacción entre cadenas laterales.
– La estructura cuaternaria depende de la interacción entre polipéptidos.
Referencias bibliográficas
1. Carey F.A. Química Orgánica, 6tª Edición. Editorial McGraw-Hill, (2006).2. Solomon E. Berg L. Martin D. Ville C. Biología 8va Edición. Editorial Interamericana Mc Graw Hill (2008).
3. Kosata D y Danne R. (2010) BKChem 0.13.0
Autora
 Escrito por Mahiceth Quintero Valero para la Edición #104 de Enciclopedia Asigna, en 09/2021. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #104 de Enciclopedia Asigna, en 09/2021. Mahiceth es Doctora en Química Aplicada