La estereoquímica es la química responsable por investigar la forma de las moléculas en tres dimensiones, sus bases fueron instituidas en 1874 por Jacobus van’t Hoff y Joseph Achille Le Bel, los cuales plantearon que los cuatro enlaces unidos al carbono se encuentran orientados hacia los vértices de un tetraedro, y como consecuencia de este arreglo tetraédrico es que dos compuestos pueden ser distintos, debido a que es diferente el arreglo de sus átomos en el espacio.
Ejemplos de las representaciones de las moléculas tridimensionales
Debido a la importancia que tiene el poder representar las moléculas tridimensionalmente los químicos han ideado varios modelos moleculares, así como la manera de representarlos en el papel, entre ellas tenemos:
Fórmulas con cuñas: consiste en utilizar una cuña de trazo grueso para representar un enlace proyectado por encima del plano del papel, una cuña a trazos para representar un enlace por debajo del plano, y líneas finas continuas para representar enlaces en el plano (figura 1).
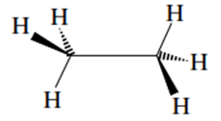
Figura 1. Cuñas
Fórmula en perspectiva caballete: esta consiste en observar la molécula ligeramente desde arriba y desde la derecha de un enlace carbono-carbono, sus enlaces están representados por líneas finas continuas, de manera que la representación angular muestre una imagen en perspectiva de la estructura. Un ejemplo de esto es representado por la figura 2.
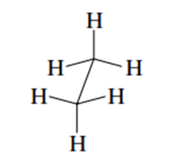
Figura 2. Perspectiva caballete
Proyección de Newman: en esta se considera la visión de la molécula directamente desde el extremo del eje de un enlace carbono-carbono. El átomo de carbono que se encuentra adelante es representado por un punto central los siguientes carbonos son representados por un círculo; es importante que las líneas de los enlaces del carbono terminan justo en el perímetro del círculo, tal como se muestra en la figura 3.
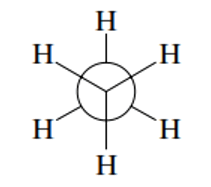
Figura 3. Proyección de Newman
Estereoisómeros
Los compuestos que poseen la misma secuencia de átomos enlazados y fórmula molecular, pero tienen distinta orientación espacial, se denominan estereoisómeros, estos se clasifican principalmente en dos tipos: los que pueden modificar su orientación espacial y transformarse fácilmente en otro isómero de la misma molécula a temperatura ambiente, a través de rotaciones sobre los enlaces sencillos se denominan estereoisómeros conformacionales y los que modifican con dificultad bajo condiciones normales y por lo tanto pueden ser aislados se denominan estereoisómeros configuracionales y por lo general implica algún proceso de ruptura de enlace.
En química orgánica toda molécula tiene una imagen especular, sin embargo, no siempre estas son superponibles, en 1894 William Thomson dio una definición de este comportamiento diciendo que una molécula es quiral si sus dos formas de imagen especular no son superponibles en tres dimensiones, por otro lado, lo opuesto a este comportamiento se denomina aquiral, pues sus imágenes especulares son superponibles. Una molécula que puede ejemplificar este concepto es el bromoclorofluorometano (BrClFCH), las imágenes especulares del bromoclorofluorometano tienen la misma conformación, es decir, los átomos están conectados en el mismo orden, pero el arreglo de sus átomos en el espacio es diferente (estereoisómeros).
Simetría en estructuras aquirales
Anteriormente, se han mencionado algunas características estructurales que han permitido determinar si una molécula es quiral o aquiral, por ejemplo, si una molécula que tiene un plano de simetría o un centro de simetría es superponible en su imagen especular y entonces es aquiral, por lo tanto, es importante definir ambos conceptos. Plano de simetría el cual parte una molécula por la mitad, de manera que una mitad de la molécula es la imagen especular de la otra mitad.
Por otro lado, un punto en el centro de una molécula es un centro de simetría siempre y cuando cualquier línea trazada a partir de él hasta algún elemento de la estructura encuentre un elemento idéntico cuando se extiende a una distancia igual en la dirección opuesta, por ejemplo: el (E)-1,2-dicloroeteno, el cual posee un centro de simetría, los dos carbonos son equidistantes del centro de la molécula y se localizan en la línea (línea punteada horizontal izquierda) que pasa por el centro; de igual manera ambos hidrógenos tienen una distancia similar hacia el centro y ambos cloros tienen una distancia igual (figura 4).
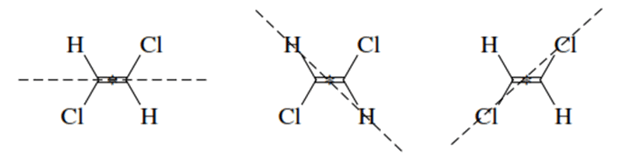
Figura 4. (E)-1,2-dicloroeteno
Referencias bibliográficas
1. Morrison R.T. Química Orgánica, 5tª Edición. Editorial Pearson, (1990).2. ACD/Labs programa simulador de moléculas Chemsketch.
Autora
 Escrito por Mahiceth Quintero Valero para la Edición #108 de Enciclopedia Asigna, en 01/2022. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #108 de Enciclopedia Asigna, en 01/2022. Mahiceth es Doctora en Química Aplicada