Los ésteres se basan en la fórmula química R ́COOR, en la que R’ puede ser hidrógeno o un grupo hidrocarbonado, y R corresponde a un grupo hidrocarbonado. Configura un compuesto orgánico producto entre la reacción de un ácido carboxílico y un grupo OH, por lo tanto, los ésteres también son conocidos como un derivado de los ácidos carboxílico, en la siguiente reacción se muestra la estructura del compuesto. Los ésteres se utilizan en la industria de perfumes debido a su agradable olor, así mismo, se los trabaja en la fabricación de sustancias para dar sabor en la industria de pastelería y refresco.
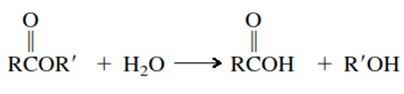
Propiedades físicas
Los ésteres son compuestos relativamente polares que poseen puntos de ebullición altos en comparación con los hidrocarburos que contienen pesos moleculares similares, esto debido a las fuerzas de atracción dipolo que tienen estas estructuras y a sus momentos dipolares que se encuentran entre 1,5 y 2D. Sin embargo, si los valores de los puntos de ebullición de los ésteres se comparan con los puntos de ebullición de los alcoholes que poseen pesos moleculares similares, se puede encontrar que los ésteres poseen menor punto de ebullición, esto se debe a que los ésteres no tienen grupos hidroxilo (OH) y por lo tanto estas moléculas no pueden formar puentes de hidrógeno entre.
Con respecto a su solubilidad los ésteres de bajo peso molecular son relativamente solubles en agua, debido a que los ésteres pueden participar en puentes de hidrógeno con sustancias que contengan los grupos hidroxilo como agua, alcoholes y ácidos carboxílicos. Sin embargo, la solubilidad en agua disminuye a medida que se aumenta en número de átomos de carbón en el éster, como por ejemplo las grasas que están constituidas por ésteres de ácidos de cadena larga con glicerol son insolubles en agua.
Nomenclatura
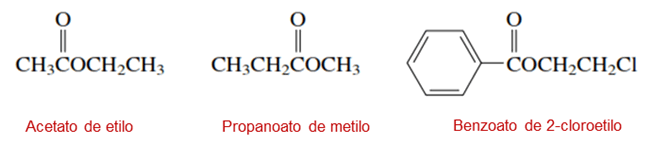
Todos los derivados de los ácidos carboxílicos como los ésteres obtienen su nombre sustituyendo, la terminación -ico del nombre de la IUPAC del ácido carboxílico por -ato. En los ésteres el grupo R’ se nombra primero seguido de la porción del acilo, este último se nombra eliminando la palabra ácido del ácido carboxílico y se sustituye la terminación -ico por la terminación -ato. Por ejemplo:
Ésteres naturales y sintéticos, y ejemplos prácticos
Existen dos tipos de fuentes de estos compuestos orgánicos: las fuentes naturales y mediante la síntesis en laboratorio.
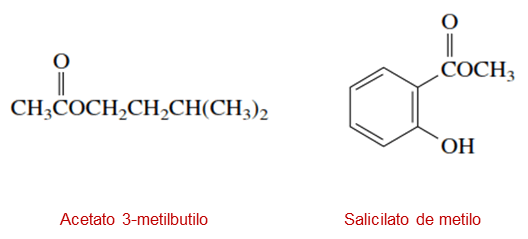
– Fuentes naturales: los ésteres forman parte considerable de la mayoría de aceites esenciales que se encuentran en las frutas y en las flores. Por ejemplo, el aroma y el sabor característico de las naranjas de debe a la presencia de acetato de octilo CH3(CH2)6CH2OOCCH3, el cual es un éster; también el olor característico de los plátanos se debe a la presencia del éster acetato de 3-metilbutilo, o el salicilato de metilo que también es un éster que se encuentra en el aceite de gaulteria, ambas estructuras se muestran a continuación:
La mayoría de las grasas y de los aceites naturales son mezclas de triésteres de glicerol que son ésteres del glicerol de origen natural.
Métodos de síntesis de ésteres en el laboratorio:
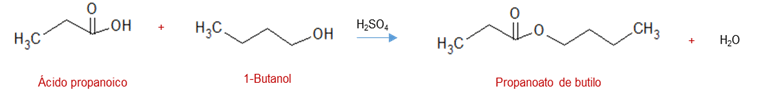
– A partir de ácidos carboxílicos: se conoce como esterificación de Fischer, la cual consiste en utilizar un catalizador ácido en presencia de alcoholes y ácidos carboxílicos para dar como productos principales éster y agua, tal como se muestra en la reacción:
– A partir de cloruros de acilo: esta reacción se lleva a cabo utilizando una base débil como la piridina, la cual permite que se realice una sustitución nucleofílica entre los alcoholes con los cloruros de acilo para formar los ésteres. Esta reacción se muestra a continuación:
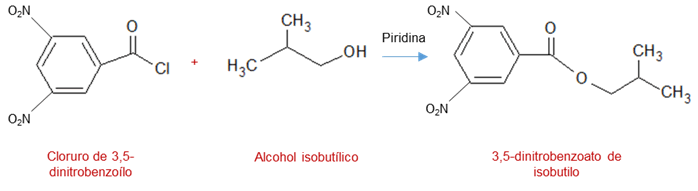
– A partir de anhídridos de ácidos carboxílicos: esta reacción es una reacción catalítica la cual es catalizada por un ácido como ácido sulfúrico o un base como la piridina y se parte de reacción entre un anhídrido ácido y un alcohol para dar un éster. Tal como se muestra en la reacción:

A partir de la oxidación de cetonas de Baeyer-Villiger: en esta reacción la cetona es transformada en éster mediante el tratamiento con peroxiácidos, donde ocurre una migración del grupo R’ del carbono al oxígeno, Tal como se muestra en la reacción:

Autora
 Escrito por Mahiceth Quintero Valero para la Edición #111 de Enciclopedia Asigna, en 05/2022. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #111 de Enciclopedia Asigna, en 05/2022. Mahiceth es Doctora en Química Aplicada