Los enlaces químicos son una fuerza que mantiene unidos a los átomos que conforman un compuesto, de tal manera que los átomos como elementos unidos, alcancen una configuración electrónica que le genera una mayor estabilidad química. El enlace iónico surge a partir de un proceso de ionización, donde uno de los átomos implicados en el enlace forme un ion positivo (catión) debido a la pérdida de electrones y el otro forme un ion negativo (anión) que se expresa ya que gana un electrón. El enlace covalente ocurre cuando los átomos involucrados comparten uno o más pares de electrones dando a lugar a un orbital, denominado orbital molecular.
Estructura y propiedades de los enlaces químicos
A través de los años los químicos han logrado comprender las propiedades químicas de los elementos, y alcanzaron la organización de estos elementos en la tabla periódica; todo este alcance ha permitido tener fundamentos para entender cómo se forman las moléculas y los compuestos.
En el periodo de 1916 a 1919 Gilbert Lewis, formuló una propuesta sobre el enlace químico, basándose en la configuración electrónica más estable, esta estabilidad máxima es alcanzada cuando un átomo es isoelectrónico con un gas noble por lo tanto en un enlace químico los electrones se transfieren o se comparten de tal manera que los átomos adquieren una configuración electrónica estable que se trata de la configuración de un gas noble.
Un enlace químico se forma a partir de la interacción entre las regiones más externas de los átomos donde juegan un papel muy importante los electrones de valencia, para tener conocimiento sobre la cantidad de electrones de valencia que se encuentran en cada átomo de los elementos presentes en un enlace, Lewis desarrolló símbolos y estructuras que estaban constituidas por, el símbolo del elemento y un punto por cada electrón de valencia del átomo del elemento. Así representó Lewis el símbolo para el silicio tomando en cuenta su configuración [Ne]3s23p2:
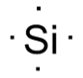
Y así representó una estructura:
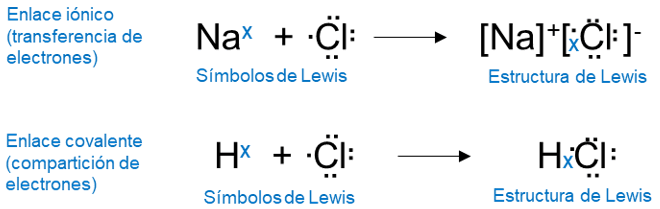
Donde la combinación de símbolos de Lewis, representa la transferencia o compartición de electrones en un enlace químico.
Enlaces iónicos
El enlace iónico se produce generalmente con los metales alcalinos y alcalinotérreos pues estos elementos poseen baja energía de ionización y por tanto tienden a formar cationes muy fácilmente; tal como se mencionó anteriormente, para formar un enlace iónico también se necesitan elementos que forman aniones y estos son por lo general elementos que tienen alta afinidad electrónica tales como los halógenos y el oxígeno. Al usar los símbolos de puntos de Lewis la reacción se representa de la siguiente manera:

Donde en principio, el litio es ionizado y en seguida el flúor acepta un electrón y finalmente se da la atracción electrostática entre el ion litio con carga positiva y el ion fluoruro con carga negativa, para dar como producto un compuesto eléctricamente neutro.
Enlaces covalentes
El par de electrones compartidos se representa con una sola línea, así por ejemplo el enlace covalente de la molécula de hidrógeno se escribe como H-H, en este enlace cada electrón del par compartido es atraído por los núcleos de ambos átomos, esta atracción mantiene unidas a los átomos en la molécula H2, y es la responsable en la formación de los enlaces covalentes.
Otro ejemplo de este tipo de enlace lo representa la molécula de flúor F2, en la cual ocurre un enlace covalente entre átomos polielectrónicos, el flúor tiene una configuración electrónica de 1s22s22p5, los electrones 1s son de baja energía y por lo tanto están muy cerca del núcleo por lo que no participan en la formación de enlaces y solo participan los electrones de valencia, la formación de la molécula F2 se representa de la siguiente manera:

Donde solo participan dos electrones de valencia (par enlazante) y se cumple la regla del octeto propuesta por Lewis donde los electrones se comparten de manera que los átomos adquieren una configuración electrónica estable y como ya se mencionó generalmente se trata de una configuración de gas noble con ocho electrones externos que componen un octeto; los electrones que no participan en la formación de enlaces, los electrones no enlazados se llaman electrones libres, por lo tanto cada átomo de F que conforman la molécula posee tres pares libres de electrones.
Los átomos pueden formar distintos tipos de enlaces covalentes, los enlaces sencillos de los cuales ya se ha venido hablando, donde se unen dos átomos por medio de un par de electrones y los enlaces múltiples donde dos átomos comparten dos o más pares de electrones, si los átomos comparten dos pares de electrones se denominan enlaces dobles, pero si comparten tres pares de electrones se denomina enlaces triples.
Referencias bibliográficas
1. Brown T.L; LeMay H.E; Bursten B.E; Burdge J.R. Química General, 12va Edición. Editorial Pearson, (2014).3. Petrucci, R.H; Herring, F. G; Madura, J.D; Bissonnette, C. Química General, 8a Edición. Editorial Pearson, (2003).
Autora
 Escrito por Mahiceth Quintero Valero para la Edición #105 de Enciclopedia Asigna, en 11/2021. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #105 de Enciclopedia Asigna, en 11/2021. Mahiceth es Doctora en Química Aplicada