La volumetría se define como todo aquel método analítico que mide el volumen de un reactivo el cual interactúa estequiométricamente con el analito, el reactivo puede ser una disolución patrón de un compuesto químico.
Propiedades generales del proceso de valoración
Para lograr entender la volumetría como una técnica de estudio cuantitativo se debe tener claro algunos conceptos importantes los cuales se mencionan a continuación. Disolución patrón o valorante, es el reactivo del cual tenemos conocimiento de su concentración y es indispensable para que se lleve a cabo una valoración, debido a la importancia de esta, debe tomarse en cuenta las propiedades de la solución patrón con la que se desee trabajar, por lo tanto, esta debe ser lo suficientemente estable de manera que la identificación de su concentración solo se realice una vez, reaccione rápidamente con el analito, su reacción sea completa y se realice una reacción única con el analito.
Para realizar una valoración se debe proceder primero a agregar lentamente la disolución patrón desde una bureta (instrumento dispensador de líquido), a una disolución de analito que se encuentra en un matraz o vaso de precipitado. La solución patrón se añade hasta que la reacción se realice por completo y alcance el punto de equivalencia. Este último, corresponde a un punto teórico que es alcanzado cuando la proporción de valorante es químicamente similar a la proporción del analito en la muestra, experimentalmente el punto de equivalencia es imposible determinar, sin embargo, se puede estimar su posición al detallar un cambio relacionado con la condición de equivalencia. Dicho cambio se llama punto final de valoración y viene indicado por un cambio de coloración que se obtiene gracias a una sustancia añadida en la muestra conocida como indicador.
La discrepancia entre el volumen del punto final y el volumen del punto de equivalencia es un error sistemático del método denominado error de valoración. La masa o el volumen del reactivo necesario para completar la reacción se determina por la diferencia entre la lectura inicial y final, algunas veces es necesario agregar un exceso de valorante patrón para luego determinar el exceso mediante una valoración por retroceso (proceso en el cual el exceso se determina por valoración con una segunda disolución).
Propiedades necesarias
En su mayoría, todas las reacciones químicas pueden funcionar para la utilización de los métodos volumétricos, siempre y cuando cumplan tres requisitos, en primer lugar todas las reacciones en la que interviene el agente valorante y el analito deben tener una estequiometría conocida, en segundo lugar la reacción de valoración debe ser rápida de lo contrario el punto final excederá el punto de equivalencia en un valor significativo, y por último debe existir un método adecuado para determinar el punto final con un grado de exactitud aceptable.
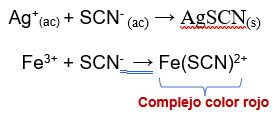
Un ejemplo simple de valoración es el utilizado para el análisis de Ag+ donde se utiliza tiocianato (SCN-) como agente valorante, esta reacción es rápida y tal como se muestra en la reacción su estequiometria es conocida, por otra parte el agente valorante SCN- es fácil de preparar si se parte de KSCN, para determinar el punto final de esta reacción se debe agregar una pequeña cantidad de Fe3+ a la disolución que contiene al analito, finalmente la formación del complejo Fe(SCN)2+ de color rojo señala el punto final. Este proceso es representado por la siguiente reacción:
Clasificación
Los métodos volumétricos incluyen un gran número de procedimientos cuantitativos que se fundamentan en la medida de la cantidad de un reactivo de concentración conocida que es consumida por un analito (especie presente en una muestra la cual se desea estudiar). Los métodos volumétricos se clasifican en cuatro grupos según el tipo de reacción involucrada, entre ellos están:
1. Las valoraciones ácido-base o neutralización, las cuales se utilizan para determinar cantidades de ácidos y bases, por lo tanto, la reacción entre el analito y el agente valorante es una reacción ácido-base.
2. Las valoraciones complexométricas, donde interviene una reacción de complejación metal-ligando, en la que se espera obtener complejos estables que permitan determinar más fácilmente el punto final.
3. Las valoraciones redox, donde se utiliza un agente oxidante reductor como agente valorante y, por lo tanto, la reacción involucrada es una reacción de oxidación-reducción.
4. Las valoraciones de precipitación donde las sustancias involucradas reaccionan para formar un precipitado.
Referencias bibliográficas
Skoog D.A, West D.M, Holler F.J. Fundamentos de química analítica, 6ª Edición. Editorial Mc Graw Hill, (1995).Autora
 Escrito por Mahiceth Quintero Valero para la Edición #106 de Enciclopedia Asigna, en 12/2021. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #106 de Enciclopedia Asigna, en 12/2021. Mahiceth es Doctora en Química Aplicada