Una reacción química es un proceso en el que un conjunto de sustancias denominado reactivo cambian para formar un conjunto de sustancias llamado productos. Los químicos utilizan una notación simbólica para representar una reacción química, a lo que se conoce como ecuación química, conteniendo la información necesaria para describir completamente el proceso químico.
Ecuaciones químicas: elementos y ejemplos
La ecuación química se representa inicialmente por las sustancias que se van a transformar y llevan el nombre de reactivos, seguidamente se presenta una flecha que es la representación de la parte activa o dinámica del proceso (en ellas se pueden representar las condiciones de reacción, es decir la transformación, y finalmente se encuentran las sustancias que se originan denominados productos. A continuación, se muestran ejemplos sobre las condiciones de reacción que suelen representarse sobre la fecha; la letra griega ∆ indica que se debe calentar la mezcla de reacción:

Mientras que, en otras reacciones, por ejemplo, se muestran las condiciones de reacción, temperatura, presión y catalizador presentes en la reacción.
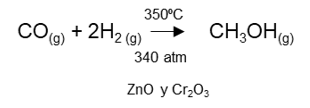
Generalmente, las reacciones químicas proporcionan información adicional como lo es el estado físico de los reactivos y productos mediante la utilización de las letras g, s y l para representar los estados sólido, líquido y gaseoso. Como por ejemplo se presenta:

Una reacción química se encuentra representado correctamente a través de una ecuación cuando hay concordancia entre las sustancias que reaccionan y los productos en relación a su masa y a su carga, es decir hay un balance entre las sustancias involucradas; para lograr este equilibrio se debe utilizar un coeficiente numérico que se coloca delante de la fórmula química de cada sustancia conocido como coeficiente estequiométrico, resultando esenciales al momento de calcular las cantidades de reactivos utilizados o de productos formados en una reacción química. Bajo ningún criterio se debe alterar los subíndices de las fórmulas, ya que se alteraría la expresión original.
Ecuación balanceada
El balanceo de las ecuaciones químicas se puede alcanzar por tanteo, procediendo de la siguiente manera: primero se debe identificar todos los reactivos y productos para escribir su fórmula correctamente tanto del lado izquierdo como del lado derecho de la ecuación, luego se prueban diferentes coeficientes para igualar el número atómico de cada elemento en ambos lados de ecuación colocando los números iniciales y modificándose si es necesario. Como por ejemplo la reacción entre el hidrógeno y oxígeno:

La ecuación balanceada muestra que dos moléculas de hidrógeno reaccionan con una molécula de oxígeno para formar dos moléculas de agua. Como en las reacciones químicas las relaciones del número de moléculas son igual a la relación del número de moles, entonces esta reacción también puede expresarse como dos moles de hidrógeno reaccionan con un mol de oxígeno para producir dos moles de agua.
Dependiendo del tipo de compuestos obtenido se tiene un proceso químico determinado, así como una reacción, es por ello que las reacciones químicas se pueden clasificar en tres grupos básicos.
Clasificación de las reacciones químicas
1. Reacciones de combinación: en este tipo de reacción se unen dos o más especies químicas con el fin de producir una sustancia con características diferentes a sus especies de origen, como ejemplo se tienen:

2. Reacciones de desplazamiento: esta reacción se caracteriza porque en ella ocurre una sustitución de un elemento dentro de un compuesto químico. Como ejemplo se presenta:

En esta reacción el hidrógeno es desplazado por el zinc para obtener el sulfato de zinc.
3. Reacción de descomposición: tal como lo indica su nombre, esta reacción involucra ruptura o separación de los componentes en las especies químicas que puede ser ocasionada por ser sometidas a calor. Como ejemplo se presenta la descomposición del óxido de mercurio:
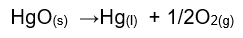
4. Reacciones con doble descomposición: este tipo de reacciones implica la ruptura de la especie química seguida de un reordenamiento de los componentes en donde ocurre un intercambio. Un ejemplo de estas reacciones es la que tiene lugar entre un ácido y un hidróxido conocido como reacción de neutralización donde el intercambio produce agua y una sal.
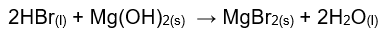
La ecuación química y la estequiometría
Una de las mayores interrogantes presentes en el químico al momento de su trabajo experimental es ¿Qué cantidad de producto se obtendrá a partir de cantidades específicas de los reactivos? Y para responder esta interrogante en forma cuantitativa se introduce el concepto de estequiometría, la cual abarca una relación entre los coeficientes estequiométricos en unidad de moles. Como ejemplo se presenta a continuación la reacción de combustión del monóxido de carbono en aire:
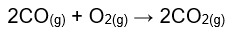
Los cálculos estequiométricos de esta ecuación pueden interpretarse como: dos moles de CO se combinan con 1 mol de oxígeno para formar dos moles de CO2.
Autora
 Escrito por Mahiceth Quintero Valero para la Edición #107 de Enciclopedia Asigna, en 12/2021. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #107 de Enciclopedia Asigna, en 12/2021. Mahiceth es Doctora en Química Aplicada