La química inorgánica analiza el comportamiento de los compuestos que no presentan carbón. Desde el punto de vista histórico, a través de los años la química orgánica es considerada como la química del carbono, y es de pensar, por otro lado, que la química inorgánica es la ciencia que estudia todos los elementos excepto el carbono. En su sentido más amplio, esto es cierto, sin embargo, esta rama de la química es muy amplia pues abarca el comportamiento químico y físico de estos elementos y compuestos, que va desde los estudios de los mecanismos y cinética de reacción, basados en las leyes de termodinámica hasta los arreglos estructurales de los átomos.
Aunque existen un sinfín de compuestos que contienen carbón, la química inorgánica es de gran importancia en la industria química, pues es fundamental en el área farmacéutica, estudio de materiales, surfactantes y catálisis.
Elementos y principios básicos en la química inorgánica
La comprensión básica de la química inorgánica está basada en el estudio del átomo y su comportamiento como, por ejemplo: los electrones presentes en un determinado átomo, la energía que posee cada electrón y su distribución. En este sentido se comprende que un átomo es la unidad fundamental más pequeña de un elemento y puede existir, solo o en combinación química con otros átomos del mismo u otro elemento, las partículas fundamentales que componen a los átomos son las protón, electrón y neutrón.
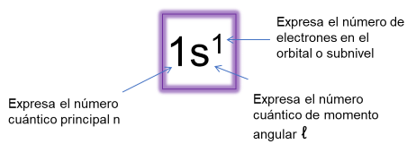
La química inorgánica estudia la distribución de los electrones basándose en la mecánica cuántica, la cual precisa tres números cuánticos derivados de la ecuación de Schrӧdinger que describen los orbitales atómicos e identifican a los electrones que están dentro, estos números cuánticos son:
– Número cuántico principal, el cual es el nivel principal de energía y puede tomar números enteros, positivos y distintos de cero, por ejemplo, n=1,2,3.
– Número cuántico secundario o momento angular (ℓ) el cual define la forma de la nube electrónica, este número puede ser cero o un número entero positivo no mayor a n-1, ℓ= 0,1,2,3. Por ejemplo si n=1, sólo existe un solo valor de ℓ y es 0, que corresponde al orbital s, el valor de ℓ se designa con las letras s, p, d, f, g, y h los cuales corresponden a los nombres de los orbitales; el conjunto de orbitales que tienen el mismo valor de n se conoce como nivel o capa y los orbitales que tienen los mismos valores de n y ℓ se conocen como subnivel o subcapa.
– Número cuántico magnético (mℓ) el cual define la orientación del orbital en el espacio, puede ser expresado como un número positivo, negativo e incluyendo el cero y depende del valor que tenga el número cuántico del momento angular, para cierto valor de ℓ existe (2 ℓ +1), por ejemplo, si ℓ=1, entonces existe (2×1 +1) o tres valores de mℓ que son -1,0 y 1.
Interpretando estos números cuánticos se presenta un ejemplo general donde n=2 y por tanto ℓ=1 entonces los valores de n y ℓ indican que se tiene un subnivel 2p y en este a su vez se tiene tres orbitales 2p (debido a que hay tres valores de mℓ: -1,0 y 1).
Existe otro número cuántico denominado espín del electrón (ms), mencionados por los investigadores Otto Stern y Walther Gerlach en 1924, el cual está relacionado con el eje de rotación de cada electrón, cada número cuántico de espín del electrón (ms) tiene valores de +1/2; -1/2 en función a la dirección a la que gira. Los cuatro números cuánticos mencionados anteriormente son suficiente para identificar por completo un electrón en cualquier orbital de cualquier átomo, es decir, se considera como el domicilio de un electrón en un átomo, sin embargo, para conocer el comportamiento electrónico de los electrones es preciso ir un poco más allá y conocer la configuración electrónica del átomo, es decir la manera en que están distribuidas los electrones entre los distintos orbitales atómicos. La escritura de la configuración electrónica en los átomos viene dada en su estado fundamental.
Por ejemplo, la configuración electrónica del átomo de hidrógeno (Z=1) se representa de la siguiente manera (para representar este análisis es importante recordar que el número de electrones de un átomo es igual a su número atómico Z):
También, es posible representar la configuración electrónica con un diagrama de orbital que muestra el spin del electrón:
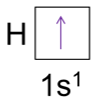
Este indica la flecha hacia arriba que representa uno de los dos posibles spines del electrón y la caja representa un orbital atómico.
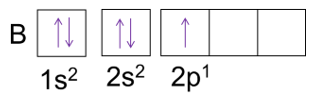
Sin embargo, para determinar la configuración electrónica de los átomos poliatómicos se debe recurrir a un principio conocido como principio de exclusión de Pauli el cual establece que no es posible “que dos electrones de un átomo tengan los mismos cuatro números cuánticos”, es decir, si dos electrones tienen el mismo valor de n, ℓ y mℓ, entonces debe tener distinto valor de ms, en otras palabras, solo dos electrones pueden estar en el mismo orbital atómico y deben tener espines opuestos. Un ejemplo de su representación es la configuración del boro donde Z= 5:
Referencias bibliográficas
Housecroft C, Sharpe A. Inorganic Chemistry, 2da Edición. Editorial Pearson, (2005).Autora
 Escrito por Mahiceth Quintero Valero para la Edición #106 de Enciclopedia Asigna, en 12/2021. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #106 de Enciclopedia Asigna, en 12/2021. Mahiceth es Doctora en Química Aplicada