Los compuestos organometálicos son aquellos que se caracterizan por poseer un enlace carbono-metal, es decir en estos compuestos existen átomos de carbono pertenecientes a moléculas orgánicas directamente unidos a ligandos o átomos metálicos; en este punto se une la química orgánica con la inorgánica y ocurren las transformaciones de compuestos orgánicos utilizando metales correspondientes a los grupos principales, series de transición, lantánidos y actínidos.
Propiedades
La presencia de ligandos es fundamental para la formación de los compuestos organometálicos, estos son definidos como moléculas o iones que poseen por lo menos un par de electrones que puedan ser donados, en la química inorgánica los ligandos también son llamados bases de Lewis los cuales son capaces de formar un enlace coordinado con un centro metálico. Este enlace metal ligando o enlace coordinado dativo puede ser explicado desde la perspectiva de la teoría de ácidos y bases de Lewis, la cual clasifica los ácidos como aceptores de electrones y las bases como donadores de electrones, por ejemplo, si se considera el siguiente complejo.
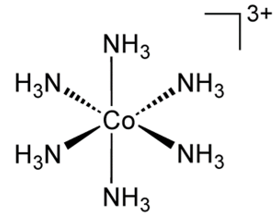
El cual se obtiene al hacer reaccionar:
Co3+ + 6NH3 → [Co(NH3)6]3+
Según Lewis, en esta reacción el catión metálico es decir el cobalto, actúa como un aceptor de electrones (ácido de Lewis) y cada molécula de amoniaco es un donador de pares de electrones (base de Lewis), existe otra teoría que explica este tipo de enlaces denominado teoría del orbital molecular el cual toma en cuenta que este ion metálico posee seis orbitales de capa de valencia donde los ejes dz2, dx2-y2, s, Px, Py y Pz, contienen lóbulos colocados a lo largo de las direcciones de los enlaces metal – ligando, estos ejes son apropiados para enlaces σ mientras que los otros ejes dxy, dyz, dzx están orientados de tal manera que solo son apropiados para enlaces π; por lo tanto cada ligando de NH3 posee un orbital σ que puede combinarse con cada uno de los orbitales de los iones metálicos.
Los compuestos organometálicos poseen propiedades distintas a la de otras clases de compuestos, ya que estas difieren entre sí por el metal, su estado de oxidación y los grupos unidos al metal utilizado, la mayoría de estos compuestos poseen un carbono nucleofílico lo que es ventajoso para la formación de enlaces carbono-carbono, como por ejemplo para la formación de alquinos.
Ejemplos de referencia
El auge del estudio de los compuestos organometálicos se produjo a finales del siglo XX, principalmente en Estados Unidos, Inglaterra y Alemania, uno de los primeros aportes fue el descubrimiento de un primer complejo llamado sal de Zeise y para 1827 fue definida su estructura de la siguiente manera:
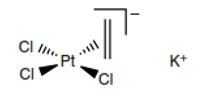
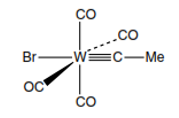
Al pasar los años fueron numerosos los estudios y descubrimientos de los compuestos organometálicos, entre los más resaltantes se encuentran, la síntesis del primer complejo metal-carbonilo el cual fue descubierto y definida su estructura por Fischer en 1971, tal como se muestra a continuación.
También a principios de la década de 1970 Richard R. Schrock descubrió los primeros complejos de alquilideno y metilideno, mostrados a continuación.
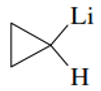
Otro de los compuestos organometálicos más utilizados en la química, en especial en la química orgánica es el llamado reactivo de Grignard, nombrado así en honor al químico francés Víctor Grignard, el cual para 1912 desarrolló el método para obtener dicho reactivo y además demostró la aplicación de este compuesto en la síntesis de alcoholes. El reactivo de Grignard se obtiene a partir de la reacción entre halogenuros orgánicos con el magnesio, tal como se muestra en la siguiente reacción.
RX + Mg → RMgX
Donde, R puede ser un metilo o alquilo, primario secundario o terciario. También puede ser un grupo cicloalquilo, alquelino o arilo, tal como se muestra en la reacción.
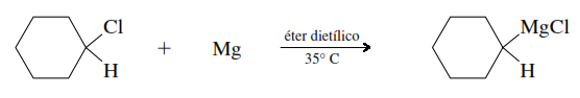
Nomenclatura de los compuestos organometálicos
Los compuestos organometálicos son nombrado como derivados sustituidos de los metales, en donde el metal se comporta como una base y los grupos alquilo unidos a este se nombran según el prefijo que le corresponda. Por ejemplo:
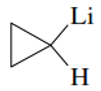
Ciclopropil-litio
Si el metal lleva un sustituyente diferente al carbono este se comporta como un anión y se nombra por separado. Por ejemplo:
(CH3CH2)2AlCl
Cloruro de dietilaluminio
Referencias bibliográficas
- Astruc D. Organometallic Chemistry and Catalysis, 1ra Edición. Editorial Reverté, (2003).Autora
 Escrito por Mahiceth Quintero Valero para la Edición #109 de Enciclopedia Asigna, en 02/2022. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #109 de Enciclopedia Asigna, en 02/2022. Mahiceth es Doctora en Química Aplicada