Son compuestos que están formados por un metal de transición como átomo central y algunos ligandos. Los metales de transición de estos complejos contienen la cada d incompleta por lo que estos elementos deben completar o llenar su subcapa con electrones dados o compartidos por los ligandos y así tener finalmente un compuesto estable. El comportamiento electrónico de estos complejos es explicado por un modelo denominado teoría de campo cristalino (TCC).
Teoría de campo cristalino (TCC)
La teoría de campo cristalino asienta sus bases teóricas al suponer que el centro metálico de un compuesto organometálico que es un metal de transición, se encuentra en estado gaseoso y libre, y los ligandos de estos compuestos actúan como cargas puntuales por lo que las interacciones metal-ligando en los compuestos organometálicos se basa en la naturaleza coulombica o electrostática que existe entre ellos; por lo tanto no existe solapamiento entre los orbitales atómicos de estas especies, es decir es como que se tratará de enlaces con carácter iónico.
De esta explicación se deriva que al acercarse los ligandos al metal los electrones de ambas especies comienzan a sentir repulsión cuando existe un aumento de la energía de los orbitales d correspondientes al metal, es decir los cinco orbitales d aumentan su energía en la misma magnitud manteniéndose degenerados ya que la TCC supone que la aproximación inicial de los electrones de estos ligandos forma una concha esférica alrededor del metal manteniendo un campo uniforme. Posteriormente a esto, los ligandos se acomodan de manera que la repulsión entre ellos sea mínima haciendo que los orbitales d orientados en la dirección de enlace metal-ligando aumente su energía, mientras que los que están orientados entre estas direcciones disminuyen su energía, sin embargo, la suma de las energías de los orbitales siempre será igual a la energía degenerada.
En este punto los orbitales d todavía permanecen en un estado alto de energía, pero la atracción entre los electrones del ligando y el centro metálico hacen que los orbitales se estabilicen y bajen su energía manteniendo el desdoblamiento de los orbitales d. El desdoblamiento del campo cristalino está asociada a la simetría del complejo, bien sea octaédrica, tetraédrica o planos cuadrados.
Un complejo octaédrico con ligandos iguales contiene seis interacciones metal-ligando y debido a su simetría de campo están ubicados cada uno a 90º de cuatro y a 180º de uno, por lo tanto, los ligandos están sobre sus ejes cartesianos.
Debido a las repulsiones electrón ligando y electrón metal a lo largo de los ejes, los orbitales d se desdoblan aumentando de energía los dx2 – y2 y dz2 que están sobre los ejes mientras que los ubicados entre los ejes dxy, dxz y dyz disminuyen su energía, representándolos de la siguiente manera:
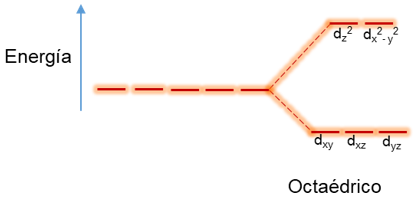
Por lo tanto, la energía de los orbitales eq (dx2– y2 y dz2) de mayor energía aumenta en +3/5 ∆oct mientras que los t2g (dxy, dxz, dyz) de menor energía disminuyen -2/5 ∆oct, donde ∆oct representa la energía del campo cristalino octaédrico y la suma de estas energías es igual a cero (2(3/5) + 3(-2/5) =0), por lo que representa la energía degenerada.
Por otro lado, en los complejos tetraédricos los ligandos están ubicados entre los ejes. En este caso los orbitales que van a sentir repulsión son los dxy, dxz y dyz por lo que su energía va ser mayor, mientras que los dx2 – y2 y dz2 disminuyen su energía de la siguiente manera:
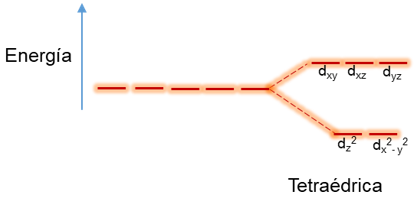
En este punto, ocurre el caso contrario al campo octaédrico pero por poseer menos ligandos y no estar orientados directamente sobre los lóbulos de los orbitales y la energía del campo cristalino va ser aproximadamente 4/9∆oct.
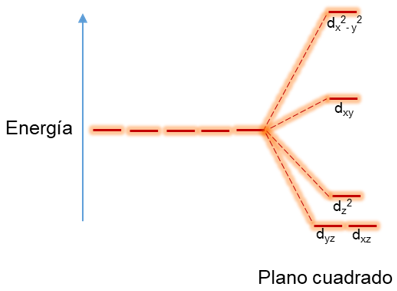
Por último, para explicar el desdoblamiento del campo cristalino de un complejo plano cuadrado se parte de un complejo octaédrico y se estudia cómo cambio la energía de los orbitales a medida que se desprenden los ligandos ubicados en posición axial. Como se observa en el siguiente diagrama al retirar los ligandos axiales la energía del orbital dz2 disminuye considerablemente aunque se mantiene por encima en energía de los orbitales dyz y dxz que por tener componente en el eje z también disminuyen en energía, debido a que hay menos ligandos y el átomo los atrae con mayor fuerza hacia él, por lo que el orbital que interacciona con los cuatro ligandos y el orbital dx2 – y2 aumenta considerablemente de energía y en menor proporción el orbital dxy que está entre los ejes del plano de los ligandos, por lo tanto en un complejo plano cuadrado los orbitales d del metal están desdoblados en cuatro niveles de energía.
Referencias bibliográficas
Astruc D. Organometallic Chemistry and Catalysis, 1ra Edición. Editorial Reverté, (2003).Autora
 Escrito por Mahiceth Quintero Valero para la Edición #109 de Enciclopedia Asigna, en 03/2022. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #109 de Enciclopedia Asigna, en 03/2022. Mahiceth es Doctora en Química Aplicada