La base de Schiff implica el producto formado por la reacción entre una amina primaria y un aldehído o cetona, los cuales también son conocidos como iminas N- sustituidas. La denominación homenajea al químico alemán Hugo Schiff, quien descubrió en 1864 la formación de estos compuestos. Estas bases son con frecuencia poco estables, sin embargo, son muy importantes como intermediarios en una secuencia de reacciones.
Cuando se adiciona amoníaco a un carbono carbonílico de un aldehído o cetona, en presencia de trazas de ácido (catálisis ácida), el producto de adición es conocido como imina, un compuesto que se caracteriza por tener un enlace -C=N-. Sin embargo, el uso del amoníaco (NH3) trae como consecuencia un producto inestable que con frecuencia tiende a polimerizarse, mientras que, si sustituimos el amoníaco por una amina primaria (RNH2) se obtendrá un producto más estable conocido como base de Schiff.
Procesos de formación de una imina y variables partícipes
El mecanismo de formación de una imina es un proceso en dos fases, el primer paso donde ocurre una adición nucleofílica de la amina al grupo carbonílico para dar la carbinolamina; y la segunda fase la cual involucra la deshidratación de la carbinolamina para obtener una imina N-alquil o N-aril sustituida, tal como puede apreciarse en la figura 1:
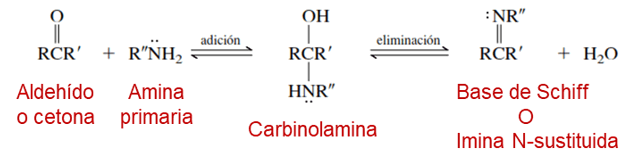
Figura 1.Mecanismo de formación de las iminas (Base de Schiff)
A continuación, se toma la reacción entre el benzaldehído y la metilamina para explicar paso a paso su mecanismo de reacción:
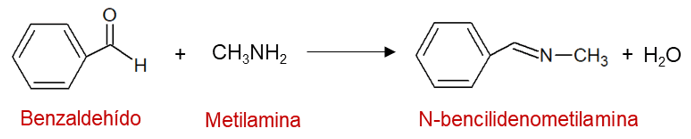
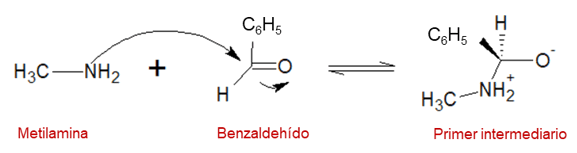
Paso 1: la amina funciona como nucleófilo y ataca el grupo carbonilo, formando el enlace C-N
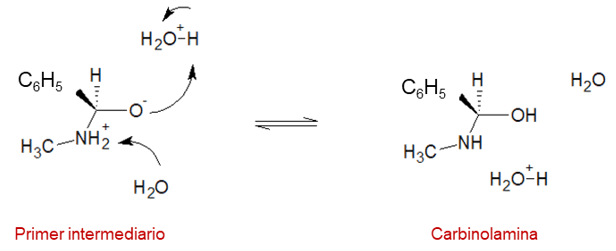
Paso 2: debido a la presencia del agua ocurre una transferencia del protón, la cual convierte al intermediario dipolar en carbinolamina.
Paso 3: ocurre una deshidratación, comenzando con la protonación del oxígeno con la carbinolamina.
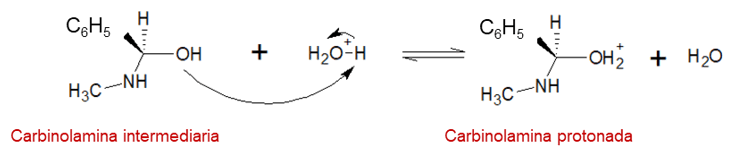
Paso 4: El oxígeno de la carbinolamina protonada pierde agua y forma un carbocatión estabilizado por el nitrógeno.

Paso 5: Por transferencia del protón al agua se forma la imina o base de Schiff.

Es fundamental regular el pH en la reacción, pues un pH óptimo de aproximadamente 5, puede llevarnos al producto deseado, un pH muy básico puede reducir la velocidad de reacción del paso cuatro y un pH muy ácido puede afectar la velocidad de reacción del paso uno.
Muchas veces encontramos a las bases Schiff como sustituyente en un anillo aromático; que a su vez tiene un grupo hidroxilo en posición orto, causante de la formación de tautómeros. Los tautómeros se refieren a las formas, en equilibrio, en las que es posible conseguir al átomo de hidrógeno ácido alfa de un compuesto carbonílico, Figura 2.
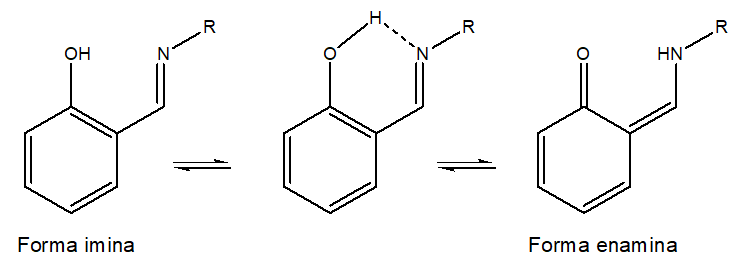
Figura 2.- Tautómeros (imina/enamina) de una o-hidroxi base de Schiff.
La presencia o ausencia de tautómeros en compuestos base Schiff ha sido confirmada mediante estudios de rayos-X y técnicas espectroscópicas, a través de las cuales se ha podido demostrar que la transferencia protónica ocurre mediante enlaces intramoleculares que pueden ocurrir de dos maneras: N-H…O y la N…H-O; así como también que la forma tautomérica influye en las propiedades físicas, químicas y biológicas de las o-hidroxi base Schiff.
La forma tautomérica (imina/enamina) que adquieren las moléculas dependen del sustituyente unido al anillo aromático y al nitrógeno de la imina, R1 de la Figura 3. Si R1 es un grupo aceptor de electrones y además está en posición (para) al hidroxilo, los electrones del oxígeno se deslocalizarán por resonancia, facilitando la transferencia del protón ácido hacia el grupo imina.
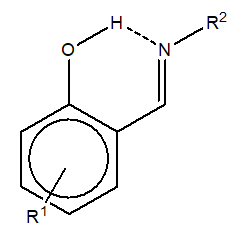
Figura 3.- Sustituyentes en una o-hidroxi base de Schiff.
El tautomerismo en las moléculas se relaciona con propiedades termocrómicas y solvatocrómicas. La primera de estas propiedades se refiere a un notable cambio de color con la variación en un intervalo de temperatura; limitado por el punto de ebullición en líquidos y solventes; así como por el punto de fusión en sólidos.
El solvatocromismo es causado por una diferencia en la solvatación (Atracción que ejercen iones del soluto, hacia las moléculas de disolvente, causando formación de enlaces covalentes débiles) que se observa entre el estado basal y el estado excitado de una molécula, una vez que absorbe un cuanto de luz del rango del ultravioleta/visible. El solvatocromismo se aprecia a través de desplazamientos batocrómico (desplazamiento de la banda, en el espectro ultravioleta, a mayor longitud de onda) o desplazamientos hipsocromico (desplazamiento de la banda de absorción a longitud de onda menores), como respuesta a un incremento en la polaridad del solvente. Dichos desplazamientos son conocidos como solvatocromismo positivo y negativo respectivamente.
Autora
 Escrito por Mahiceth Quintero Valero para la Edición #109 de Enciclopedia Asigna, en 02/2022. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #109 de Enciclopedia Asigna, en 02/2022. Mahiceth es Doctora en Química Aplicada