Gases refiere simplemente a un estado de la materia, donde las sustancias que lo representan se comportan según las leyes de los gases ideales, que vienen establecidas por Boyle, Charles, Avogadro entre otros, diferenciándose del resto de los estados (sólido y líquido) debido a que las moléculas que las constituyen están muy separadas entre sí.
Los gases se caracterizan como tal porque no tienen una forma definida pues adoptan la forma y el volumen del reciente en el que se encuentran, sus moléculas pueden mezclarse completa y uniformemente, y poseen densidades mucho menores que los sólidos y los líquidos. Se dice que un elemento es un gas cuando es condiciones atmosféricas normales de temperatura y presión (25ºC y 1atm de presión) se encuentran en estado gaseoso, algunos elementos de la tabla periódica como el hidrógeno, nitrógeno, oxígeno, flúor y cloro se encuentran en estado gaseoso, así como también los gases nobles He, Ne, Ar, Kr, Xe y Rn; en la naturaleza algunos de estos elementos se encuentran como moléculas diatómicas gaseosas tales como H2, N2, O2, F2 y Cl2 mientras que el resto, es decir los gases nobles se encuentran como gases monoatómicos.
Leyes elementales de los gases: Boyle, Charles y Gay-Lussac, y Avogadro
Hoy día se tiene establecido que la condición física de un gas requiere de ciertas variables como: volumen, temperatura, presión y cantidad de gas; matemáticamente si se conocen al menos tres de estos valores se puede obtener el valor de la propiedad desconocida, esto a través de una ecuación matemática llamada ecuación de estado o ecuación del gas ideal. Existen incontables experimentos que simbolizan el estudio de las propiedades físicas de los gases y que representan una etapa importante en la historia de la ciencia. A continuación, se muestran los más resaltantes, los cuales se consideran leyes elementales de los gases:
Ley de Boyle: en el siglo XVII Boyle estudió la relación entre la presión y el volumen de una muestra del gas utilizando un sistema, en el cual el gas se encontraba contenido dentro de un cilindro que se cerraba mediante un pistón sin peso, que se movía libremente, y la presión del gas dependía del peso total colocado encima del pistón, esta fuerza dividida por el área del pistón daba la presión del gas, por lo tanto si este peso se duplicaba también se duplicaba la presión del gas y el volumen de este disminuía hasta hacerse la mitad del valor inicial. Llevando así, a concluir que:

Este comportamiento se obtiene considerando que la temperatura del sistema gaseoso se mantiene constante. De esta manera su resultado fue expresado como se muestra a continuación:
P∝ \(\frac{1}{V}\) ó PV=a (a es una constante)
Donde ∝ representa el símbolo de proporcionalidad, por lo tanto, está expresión matemática indica que la presión es inversamente proporcional al volumen del gas.
Ley de Charles y de Gay-Lussac: ellos de manera independiente estudiaron el comportamiento del volumen del gas en función a la variación de la temperatura, manteniendo la presión como un valor constante, Charles para 1787 y Gay-Lussac 1802 publicaron sus observaciones los cuales llevaron a concluir, que:

Y sus resultados fueron expresados matemáticamente de la siguiente manera:
V∝T ó V=aT (a es una constante)
Ley de Avogadro: esta investigación completa definitivamente los trabajos hechos, por un lado de Boyle, y por el otro de Charles y Gay-Lussac. Avogadro:

Por lo tanto, el volumen de un gas debe ser directamente proporcional al número de moles de las moléculas presentes, y se representa matemáticamente de la siguiente manera:
V∝n ó V=kn
Donde n, corresponde al número de moles y k a la constante de proporcionalidad.
Según Avogadro:

De este modo, por ejemplo, se presenta la siguiente reacción:
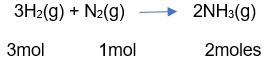
Si estos gases se encuentran a la misma temperatura y presión, entonces sus volúmenes son directamente proporcionales al número de moles, de los gases presentes y la relación en la reacción se expresa así:
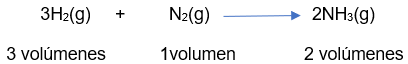
Al observar las leyes ya mencionadas se puede describir el comportamiento del volumen en función a la modificación de una variable, mientras que el resto se mantienen constantes:
1. Ley de Boyle “define el efecto de la presión V∝ \(\frac{1}{P}\) (n y T constante)”
2. Ley de Charles “define el efecto de la temperatura V∝T (n y P constante)”
3. Ley de Avogadro “define el efecto de la cantidad de gas V∝n (T y P constante)”
Es posible combinar estas tres expresiones, para dar una única ecuación denominada ecuación de los gases ideales o ecuación de estado, la cual incluye las cuatro variables ya mencionadas:
V∝ \(\frac{nT}{P}\)
V=R \(\frac{nT}{P}\)
ó
PV=nRT (ecuación de gases ideales)
Donde:
R=constante universal de los gases (0,082057 atm*L*mol-1*K-1; 62,364 L*Torr*mol-1*K-1; 8,3114 m3*Pa*mol-1*K-1; 8,3145 J*mol-1*K-1)
n=cantidad de moles del gas
P=Presión del gas
T=Temperatura del gas
V=Volumen del gas
Referencias bibliográficas
1. Brown T.L; LeMay H.E; Bursten B.E; Burdge J.R. Química General, 12va Edición. Editorial Pearson, (2014).2. Petrucci, R.H; Herring, F. G; Madura, J.D; Bissonnette, C. Química General, 8a Edición. Editorial Pearson, (2003).
Autora
 Escrito por Mahiceth Quintero Valero para la Edición #105 de Enciclopedia Asigna, en 10/2021. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #105 de Enciclopedia Asigna, en 10/2021. Mahiceth es Doctora en Química Aplicada