El benceno es un hidrocarburo líquido volátil con punto de ebullición de 80ºC, es la estructura fundamental de una amplia clase de sustancias, bien sea de origen natural como de origen sintético. La calificación de aromáticos tiene su origen en los aromas característicos asociados a estos compuestos, sin embargo, ya en la química moderna el término aromaticidad está asociada a las característica química y física de estos compuestos. Todos los compuestos orgánicos que poseen estructuras y comportamientos químicos semejantes al benceno son considerados hidrocarburos aromáticos.
El benceno fue aislado por primera vez en 1825 por Michael Faraday partiendo del gas de alumbrado o gas de coque, el producto obtenido para ese momento fue llamado bicarburo de hidrógeno. Años más tarde, el químico alemán Eilhardt Mitscherlich, sintetizó el mismo compuesto partiendo de ácido benzoico y cal, encontrando que este hidrocarburo poseía la fórmula empírica de C6H6, como se muestra en la siguiente reacción.
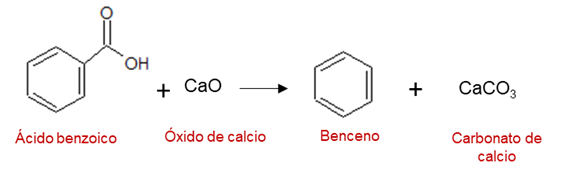
Estructura del benceno
Tal como se señaló anteriormente la fórmula molecular del benceno para 1825 ya era conocida, el siguiente paso correspondía a determinar cómo se encontraban distribuidos los distintos átomos. La estructura del benceno fue propuesta por el químico orgánico alemán August Kekulé en 1865, el cual propuso una estructura cíclica, dibujando inicialmente la fórmula estructural del benceno como un simple hexágono y unos años más tarde añadió dobles enlaces alternados con el fin de cumplir el carácter tetravalente del átomo de carbono, tal como se muestra a continuación.

Sin embargo, algunos químicos sugirieron otras posibles estructuras ya que encontraron algunas inconsistencias entre la representación estructural propuesta por Kekulé y la reactividad del mismo, entre esas se encuentran la estructura propuesta por Ladenburg el cual es un prisma totalmente saturado; y la propuesta de Dewar representada por un biciclo hexadieno, estas propuestas fueron descartadas en los años sesenta debido a que se lograron sintetizar compuestos con las estructuras de los bencenos de Ladenburg y Dewar y se comprobó que no se trataba de benceno.
Más adelante Kekulé se da cuenta de que la fórmula estructural que él propuso, implicaba que las reacciones de sustitución que podían ocurrir, conducían a tres productos disustituidos por lo que los designó como isómeros orto, meta y para. La existencia de estos tres isómeros fue demostrada experimentalmente, tal como se muestra a continuación.
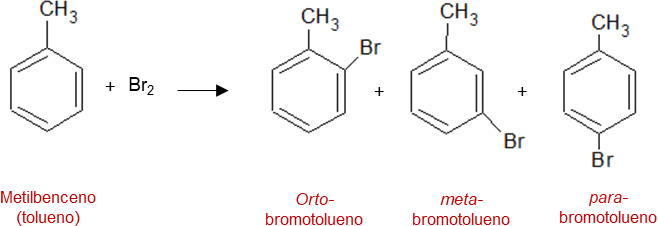
Otro de los problemas asociados a la representación de Kekulé era que deberían crearse dos isómeros orto dependiendo de la ubicación de los dobles enlaces, para ello existió la propuesta estructural (prismano) por el químico alemán Ladenburg, la cual es rechazada luego que Kekulé argumento que solo se observa un isómero orto porque todas las posiciones anulares del benceno son equivalentes y por lo tanto, debe tener lugar algún tipo de oscilación de enlaces alrededor del anillo para dar esta equivalencia, es decir los enlaces que eran dobles se convierten en simples y viceversa velozmente, este proceso se conoce como resonancia. Este comportamiento además permite que la molécula del benceno no presente una estructura rígida.
Representación orbital
Para la descripción orbital del benceno se debe considerar el estudio de sus orbitales de enlaces, cada átomo de carbono que corresponde al benceno se encuentra unido a otros tres átomos formando orbitales híbridos sp2, como el benceno es una molécula plana donde todos los carbonos e hidrógenos que contiene se encuentran ubicados en el mismo plano, además es una molécula simétrica se forman en cada caso tres enlaces sigma σ. A parte de los tres orbital ya empleados a cada átomo de carbono le queda un orbital pz libre (un electrón en cada orbital), los cuales se pueden solapar con cualquiera de los enlaces vecinos, formando el enlace π. Como resultado se obtienen dos nubes de electrones π en forma de rosca uno por encima y el otro por debajo del plano de los átomos de carbono.
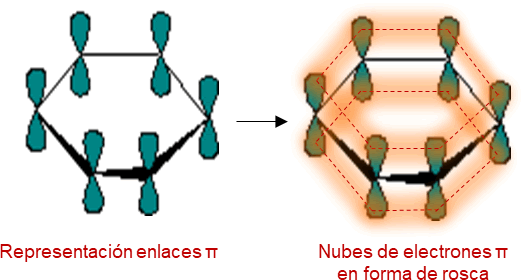
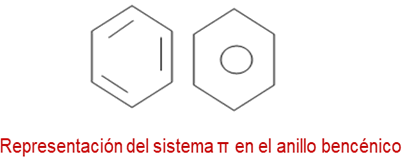
Como ya se mencionó anteriormente la molécula de benceno es plana y simétrica cuyos ángulos de enlaces son iguales a 120º, estas características permiten el apareamiento en cualquier dirección de los orbitales π, lo que permite la deslocalización de los electrones y en consecuencia, genera su estabilidad. La representación del sistema π en el anillo bencénico viene dado como un híbrido entre las estructuras de Kekulé y se representa como un círculo completo dentro de la estructura hexagonal.
Carácter aromático. Regla de Hückel
Los compuestos aromáticos se caracterizan por ser sustancias cuyas estructuras poseen un alto grado de insaturación, contienen una estructura plana o casi plana, deben ser cíclicas, cada carbono debe formar orbitales híbridos sp2 y debe cumplir con la regla de Hückel; el cual indica que el número de electrones π es igual a 4n + 2, donde n es un número entero positivo o cero. El benceno cumple con estas características ya que es un compuesto cíclico, plano y posee seis electrones π por lo que es el representante de los compuestos aromáticos.
Nomenclatura
Los derivados monosustituidos del benceno se nombran anteponiendo el nombre del sustituyente a la palabra del benceno, por ejemplo:
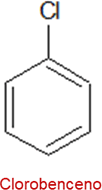
De igual manera, se nombran los derivados disustituidos del benceno, con la diferencia de que se indican las posiciones con su respectiva numeración, por ejemplo:
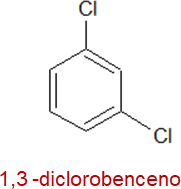
Estos derivados disustituidos también se pueden nombrar usando los prefijos orto (o), meta (m) o para (p), por ejemplo:
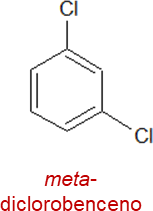
Existen algunos derivados del benceno que reciben nombres especiales como, por ejemplo:
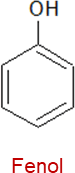
Propiedades físicas
Entre las propiedades físicas más importantes de estos compuestos se encuentran:
– El punto de ebullición, el cual aumenta al aumentar su peso molecular y en algunos casos disminuye al disminuir la polaridad.
– Debido a la baja polaridad que poseen estos compuestos, ellos son insolubles en agua, pero solubles en solventes orgánicos.
– Entre más simétrica sea la molécula bencénica, esta poseerá un punto de fusión mayor.
Propiedades químicas
– Los anillos bencénicos poseen una gran estabilidad, lo que hace que las reacciones con estos compuestos ocurran muy lentamente y por lo tanto se necesite de la presencia de catalizadores.
– El anillo del benceno sirve de fuente de electrones a reactivos deficientes de electrones.
– Las reacciones más comunes del benceno ocurre por un mecanismo llamado sustitución electrofílica, entre las principales reacciones se encuentran: halogenación, nitración, sulfonación y alquilación y acilación de Friedel-Crafts.
Referencias bibliográficas
1. Carey F.A. Química Orgánica, 6tª Edición. Editorial McGraw-Hill, (2006).2. Morrison R.T. Química Orgánica, 5tª Edición. Editorial Pearson, (1990).
3. ACD/Labs programa simulador de moléculas Chemsketch.
Autora
 Escrito por Mahiceth Quintero Valero para la Edición #141 de Enciclopedia Asigna, en 10/2024. Mahiceth es Doctora en Química Aplicada
Escrito por Mahiceth Quintero Valero para la Edición #141 de Enciclopedia Asigna, en 10/2024. Mahiceth es Doctora en Química Aplicada