El agua es un líquido incoloro, inodoro (que no posee olor) y no posee sabor. La molécula del agua es el H2O es de las moléculas más sencillas que existen, sin embargo, su conformación y estructura le confiere cualidades fisicoquímicas peculiares que hacen de esta molécula un completo fenómeno. El agua es un líquido más famoso a nivel mundial, todos conocemos acerca de su importancia tanto para el planeta como para los seres vivos, pero ¿Sabes qué es lo que hace tan especial a esta molécula?
Estructura
El agua (H2O), también conocido como monóxido de dihidrógeno, está formado por dos átomos de hidrógeno y uno de oxígeno unidos por enlaces covalentes. La molécula del H2O tiene forma tetraédrica, la cual puedes observar en la siguiente imagen, en donde el oxígeno se encuentra en la parte superior y los dos hidrógenos se encuentra colocados en ambos lados en la parte inferior separados por un ángulo de 104.50°.
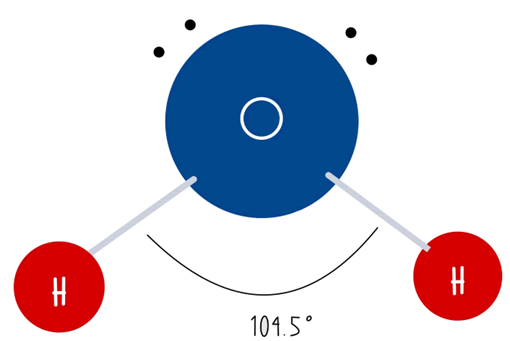
Esta estructura es de suma importancia, ya que permite a la molécula realizar diferentes enlaces y disociaciones que impactan en sus distintas propiedades como su densidad, polaridad, capacidad de disolución y entre otras de las cuales hablaremos más adelante.
Características
Capacidad de disolvencia
La principal característica del agua es su capacidad de disolver las sustancias que se encuentran inmersas en él. Esta característica es consecuencia de las cargas eléctricas de la molécula. El H2O es una molécula polar; se considera que una molécula es polar cuando no posee una carga homogénea, es decir, posee ambas cargas: positiva y negativa.
Polaridad
Para entender un poco acerca de la polaridad de una molécula tenemos que tener presente la electronegatividad que poseen los átomos que la conforman. Recuerda que la electronegatividad es la capacidad de un átomo para atraer los electrones de un átomo diferente.
• El oxígeno es considerado uno de los elementos más electronegativos de la tabla periódica y por ende tiene la capacidad de atraer los electrones de los átomos que lo rodean, dada esta característica se le designará una carga negativa.
• El hidrógeno es de los elementos menos electronegativos y por ello prefiere ceder su electrón a los átomos que se encuentran a su alrededor, por ello se le asigna una carga positiva.
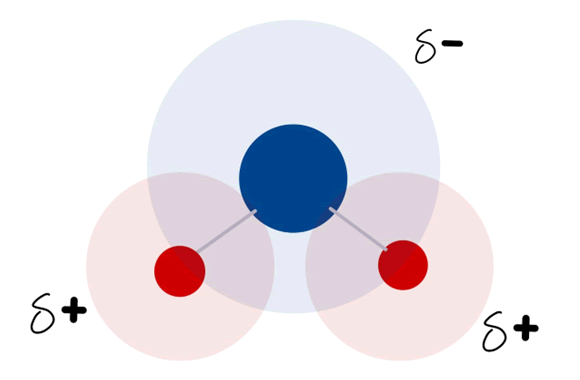
Al ser el átomo de oxígeno más grande y más electronegativo que los átomos de hidrógeno, las dos cargas eléctricas se encuentran desbalanceadas, confiriéndole a la molécula del agua una polaridad. Te puedes ayudar en la siguiente imagen para que la idea quede más clara, en donde el área color azul representa la carga negativa y la de color rojo representa la carga positiva.
Puentes de Hidrógeno
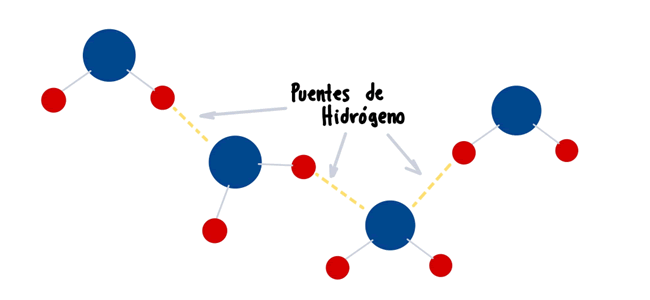
Un puente de hidrógeno es un enlace débil que generalmente ocurre entre moléculas de Hidrógeno y Oxígeno estos enlaces son causa de la atracción de cargas positivas y negativas. Este tipo de enlace no comparte electrones, por ello es un enlace muy flexible que le permite realizar muchas reacciones.
Como ya sabrás las cargas opuestas se atraen, imagínate que tienes dos imanes y juntas las caras con cargas opuestas, lo que pasará será que los imanes se pegaran automáticamente a causa del magnetismo, cuando quieras separar los imanes solo bastará con aplicar un poco de fuerza para lograrlo. Ahora imagínate que el Hidrógeno (con carga positiva) y el Oxígeno (con carga negativa) se encuentran, lo más probable que ocurra es que se atraigan por el magnetismo y al igual que con los imanes solo bastará un poco de fuerza para poder separarlos.
Estos puentes de hidrógeno son muy útiles en la naturaleza, a pesar de que son muy débiles, cuando se encuentran en grandes cantidades pueden dotar de estabilidad y fuerza a la solución en la que se encuentran.
Densidad
Una vez que ya entendiste acerca de cómo es que funcionan los puentes de hidrógeno podemos pasar a explicar el porqué de otras características como la densidad. Por ejemplo ¿sabes por qué el hielo flota en el agua?
Esto se debe al arreglo de los puentes de hidrógeno al momento en el que el agua se encuentra en estado sólido. Si pudiéramos ver los átomos de agua en estado líquido veríamos un revoltijo de moléculas que debido al flujo se encuentran en constante movimiento, lo que les impide generar puentes de hidrógeno estables. Por el contrario, si viéramos los átomos de un cubo de hielo lograríamos observar que se encuentran en forma de una red cristalina, debido a que los puentes de Hidrógeno generados están en completo orden.
Debemos recordar que la densidad es la relación entre el peso de una sustancia con respecto al espacio que ocupa. El agua en estado líquido posee una densidad de 1g/cm3 y cuando se encuentra en estado sólido posee una densidad de 0.9g/cm3. Es decir que por cada cm3 de agua líquida existen más moléculas de agua que en un cm3 de agua congelada, esto debido al arreglo estructural de los puentes de hidrógeno.

Átomos de agua en estado sólido
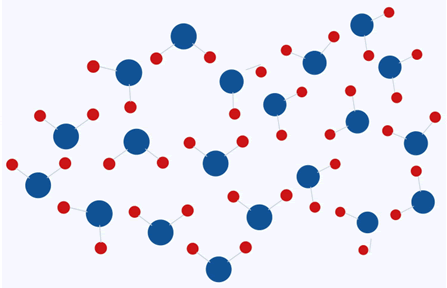
Átomos de agua en estado líquido
Interacciones Hidrofóbicas e Hidrofílicas
La polaridad del agua genera interacciones con otras moléculas, ya que se atraen, repelen o no reaccionan con otras moléculas debido a las cargas. Estas se caracterizan concorde a la capacidad de la molécula de reaccionar o no con el agua.
• Sustancias hidrofílicas: son moléculas que sí reaccionan con el agua, llevando a cabo reacciones químicas.
• Sustancias hidrofóbicas: son moléculas que no reaccionan con el agua, por lo que no llevan a cabo ninguna reacción. Tal es el caso de los aceites o grases, las cuales nunca reaccionan en presencia de agua y por ello siempre se separan.
Comportamiento térmico del agua
¿Te has preguntado por qué el agua tarda tanto en hervir? Debido a sus características, el agua tiene la capacidad de almacenar mucha energía calorífica. De hecho, el agua posee un alto valor de calor específico, el cual es de 1 kcal/kg°C. El calor específico es la energía necesaria para elevar la temperatura de 1gr de una sustancia en 1°C.
Este alto valor se debe, nuevamente, a la capacidad del agua en formar puentes de Hidrógeno. Como se mencionaba anteriormente, un puente de hidrógeno por sí solo es muy débil, pero cuando se encuentran en grandes cantidades se convierten en fuertes agregados tridimensionales.
Las moléculas de agua absorben la energía térmica almacenándola instantáneamente en los puentes de hidrógeno, cuando la energía es demasiada esta rompe los puentes, sin embargo, una vez que se rompe un puente de hidrógeno otro se vuelve a formar rápidamente debido a las cargas opuestas del hidrógeno y oxígeno. Por lo que se requiere de un mayor dote de energía para lograr romper los puentes de hidrógeno en definitivo y que estos no se vuelvan a formar.
Al aumentar la temperatura, las moléculas de agua aumentan su movimiento, impidiendo que puedan formar puentes de hidrógeno y rompiendo los puentes que quedan. Cuando se alcanza el punto de ebullición, las moléculas de agua se liberan una de la otra y se vaporizan. Esta peculiaridad no pasa con otras moléculas de tamaño y peso moléculas similares al agua, por lo que hace de esta característica una de las más peculiares que posee la molécula del agua.
Referencias bibliográficas
• Trudy McKee, James R. McKee. (2013). CAPÍTULO 3: El agua: la matriz de la vida. En Bioquímica. Las bases moleculares de la vida, 5e(.). México : McGraw Hill.• ÁNGELES CARBAJAL AZCONA Y MARÍA GONZÁLEZ FERNÁNDEZ. (2012). Propiedades y funciones biológicas del agua. de Departamento de Nutrición, Facultad de Farmacia, Universidad Complutense de Madrid.
• Ana M.; Amábile-Cuevas, Carlos F.. (2013). El agua en bioquímica y fisiología. Acta Pediátrica de México, vol. 34, núm. 2, pp. 86-95.
• Francis A. Carey & Robert M. Giuliano. (2006) Química Orgánica. México: Mc Graw Hill.
Autora
 Escrito por Valeria Lemus Castillo para la Edición #111 de Enciclopedia Asigna, en 05/2022. Valeria es Ingeniera en Biotecnología. Egresada de la Universidad Politécnica de Tlaxcala y estudiante de la maestría en Biotecnología Aplicada por el Centro de Investigación de Biotecnología Aplicada CIBA del Instituto Politécnico Nacional.
Escrito por Valeria Lemus Castillo para la Edición #111 de Enciclopedia Asigna, en 05/2022. Valeria es Ingeniera en Biotecnología. Egresada de la Universidad Politécnica de Tlaxcala y estudiante de la maestría en Biotecnología Aplicada por el Centro de Investigación de Biotecnología Aplicada CIBA del Instituto Politécnico Nacional.
